题目内容
6.下列表达正确的是( )| A. | N2的电子式为 | B. | H2S的电子式可表示为 | ||
| C. | 用电子式表示Na2O的形成过程为 | D. | MgCl2的电子式为 |
分析 A.漏掉了N原子的1对未成键电子对;
B.硫化氢为共价化合物,不存在阴阳离子;
C.氧化钠的电子式中,两个钠离子不能合并;
D.氯化镁为离子化合物,电子式中需要标出阴阳离子所带电荷.
解答 解:A.氮气分子中含有1个氮氮三键,N原子最外层满足8电子稳定结构,氮气正确的电子式为 ,故A错误;
,故A错误;
B.H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,其正确的电子式为 ,故B错误;
,故B错误;
C.Na2O为离子化合物,两个钠离子不能合并,用电子式表示Na2O的形成过程为 ,故C错误;
,故C错误;
D.氯化镁为离子化合物,镁离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,MgCl2的电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查常见化学用语的表示方法,题目难度不大,明确电子式的概念及书写原则为解答关键,注意掌握离子化合物与共价化合物的电子式的区别,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
3.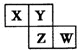 X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
 X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )| A. | X、Y、Z的原子半径大小:X>Y>Z | |
| B. | Y、Z的气态氢化物的热稳定性:Y<Z | |
| C. | Z、W的最高价氧化物对应水化物的酸性:Z<W | |
| D. | X、W的气态氢化物相互反应,生成物中既含离子键又含极性键和非极性键 |
4.下列现象中,不是因为发生化学反应而产生的是( )
| A. | 将苯滴入溴水中,振荡后水层接近无色 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 甲烷与氯气混合,光照一段时间后黄绿色消失 | |
| D. | 乙烯使溴的四氯化碳溶液褪色 |
1.在证明海带中存在碘元素的实验操作中,主要仪器选用错误的是( )
| 选项 | 操作 | 主要仪器 |
| A | 称取3.0g干海带 | 托盘天平 |
| B | 灼烧干海带至完全变成灰烬 | 烧杯 |
| C | 过滤煮沸后的海带灰与水的混合液 | 漏斗 |
| D | 用四氯化碳从氧化后的海带灰浸取液中提取碘 | 分液漏斗 |
| A. | A | B. | B | C. | C | D. | D |
1.下列关于烷烃的叙述中不正确的是( )
| A. | 在烷烃分子中,所有的化学键都为单键 | |
| B. | 所有的烷烃在一定条件下都能与Cl2发生取代反应 | |
| C. | 随着碳原子数的增加,烷烃的熔、沸点逐渐升高 | |
| D. | 任何烷烃分子中碳氢原子个数之比都是相同的 |
11.下列关于二氧化硫的性质描述正确的是( )
| A. | 无毒 | B. | 无色 | C. | 无味 | D. | 难溶于水 |
18.下列有关元素周期表的说法不正确的是( )
| A. | 元素周期表共有16个族 | B. | 元素周期表含元素最多的是第ⅢB族 | ||
| C. | 第ⅡA族与第ⅢA族不相邻 | D. | 第ⅠA族元素又称为碱金属元素 |
15.某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )
| A. | 用铜片、铅笔芯作电极插入稀硫酸中 | |
| B. | 用两个铜片作电极插入硝酸银溶液中 | |
| C. | 用锌片、铜片作电极插入酒精中 | |
| D. | 用铜片、铁片作电极插入柠檬汁中 |
16. 央视3.15晚会曝光在液化石油气中掺混二甲醚的事件.二甲醚(常压下沸点-24.9℃)是一种可溶于水的化工原料,常被用作一些燃料的替代品,其结构式如图.下列有关二甲醚的叙述中正确的是( )
央视3.15晚会曝光在液化石油气中掺混二甲醚的事件.二甲醚(常压下沸点-24.9℃)是一种可溶于水的化工原料,常被用作一些燃料的替代品,其结构式如图.下列有关二甲醚的叙述中正确的是( )
 央视3.15晚会曝光在液化石油气中掺混二甲醚的事件.二甲醚(常压下沸点-24.9℃)是一种可溶于水的化工原料,常被用作一些燃料的替代品,其结构式如图.下列有关二甲醚的叙述中正确的是( )
央视3.15晚会曝光在液化石油气中掺混二甲醚的事件.二甲醚(常压下沸点-24.9℃)是一种可溶于水的化工原料,常被用作一些燃料的替代品,其结构式如图.下列有关二甲醚的叙述中正确的是( )| A. | 二甲醚是一种有机物,属于非电解质 | |
| B. | 4.6g该物质中含有共价键的数目为7×6.02×1022 | |
| C. | 二甲醚与甲醇(CH3OH)互为同系物 | |
| D. | 0.5mol二甲醚完全燃烧生成22.4LCO2 |