题目内容
下列物质的分类组合全部正确的是( )
| 编组 | 强电解质 | 弱电解质 | 非电解质 |
| A | NaCl | H2O | Cl2 |
| B | H2SO4 | CaCO3 | CCl4 |
| C | AgCl | HClO | Cu |
| D | Ba(OH)2 | H2S | C2H5OH |
| A、A | B、B | C、C | D、D |
考点:强电解质和弱电解质的概念,电解质与非电解质
专题:物质的分类专题
分析:电解质是指:该物质是化合物,溶于水溶液中或在熔融状态下就能够导电,是自身电离.酸、碱、盐都是电解质,在水溶液中和在熔融状态下两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质.强电解质一般是强酸、强碱和活泼金属氧化物以及大部分盐,它们溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物,弱电解质部分电离,据此即可解答.
解答:
解:A.NaCl属于盐,溶于水的部分或者熔融状态时,可以完全电离变成离子,属于强电解质;水电离程度很小属于极弱电解质;Cl2是单质,它既不是电解质也不是非电解质;故A错误;
B.H2SO4属于酸,溶于水的部分,可以完全电离变成离子,属于强电解质;CaCO3属于盐,溶于水的部分或者熔融状态时,可以完全电离变成离子,属于强电解质;CCl4属于非电解质;故B错误;
C.AgCl属于盐,溶于水的部分或者熔融状态时,可以完全电离变成离子,属于强电解质;HClO属于酸,溶于水的部分部分电离是弱电解质;金属铜是单质,它既不是电解质也不是非电解质;故C错误;
D.Ba(OH)2属于碱,溶于水的部分或者熔融状态时,可以完全电离变成离子,属于强电解质;H2S在水溶液中不能完全电离是弱酸;乙醇在水溶液中和在熔融状态下两种情况下都不能导电的化合物是非电解质;故D正确;
故选D.
B.H2SO4属于酸,溶于水的部分,可以完全电离变成离子,属于强电解质;CaCO3属于盐,溶于水的部分或者熔融状态时,可以完全电离变成离子,属于强电解质;CCl4属于非电解质;故B错误;
C.AgCl属于盐,溶于水的部分或者熔融状态时,可以完全电离变成离子,属于强电解质;HClO属于酸,溶于水的部分部分电离是弱电解质;金属铜是单质,它既不是电解质也不是非电解质;故C错误;
D.Ba(OH)2属于碱,溶于水的部分或者熔融状态时,可以完全电离变成离子,属于强电解质;H2S在水溶液中不能完全电离是弱酸;乙醇在水溶液中和在熔融状态下两种情况下都不能导电的化合物是非电解质;故D正确;
故选D.
点评:本题考查了电解质的概念,考查了强弱电解质的区别,解题时抓住电解质必须是化合物,强电解质必须能完全电离解题,题目难度不大.

练习册系列答案
相关题目
下列有关生活中的化学的叙述中错误的是( )
①向燃料煤中加入生石灰,可以减少对大气的污染
②用双氧水清洗伤口,可以杀菌消毒
③只用淀粉溶液就能检验出食盐中是否加碘
④使用明矾可以对饮用水进行消毒、杀菌
⑤硫酸钡是一种难溶于水、难溶于酸的盐,可用作X光透视肠胃的内服药剂.
①向燃料煤中加入生石灰,可以减少对大气的污染
②用双氧水清洗伤口,可以杀菌消毒
③只用淀粉溶液就能检验出食盐中是否加碘
④使用明矾可以对饮用水进行消毒、杀菌
⑤硫酸钡是一种难溶于水、难溶于酸的盐,可用作X光透视肠胃的内服药剂.
| A、①③④ | B、①②⑤ |
| C、③④ | D、③④⑤ |
含有下列哪种分子或离子的试剂加入到含有Br-的溶液中可将Br-氧化为Br2( )
| A、I2 |
| B、I- |
| C、Cl2 |
| D、Cl- |
下列关于杂化轨道的叙述中,不正确的是( )
| A、杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
| B、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| C、杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D、sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° |
钢铁腐蚀发生得最普遍的是( )
| A、化学腐蚀 | B、析氢腐蚀 |
| C、吸氧腐蚀 | D、摩擦 |
下列溶液中,Na+数目最多的是( )
| A、1 mol?L-1 Na2SO4溶液100mL |
| B、0.9 mol?L-1Na3PO4溶液100mL |
| C、2.5 mol?L-1NaOH 溶液100mL |
| D、1 mol?L-1 NaHCO3溶液100mL |
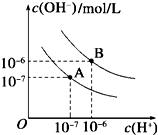 水的电离平衡线如图所示.
水的电离平衡线如图所示.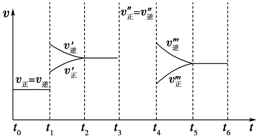 密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题.
密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题.