题目内容
2.设NA为阿佛加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,8 g O2含有电子数目为4NA | |
| B. | 1 L 0.1mol/L的氯化铵溶液中NH4+的数目为0.1NA | |
| C. | 常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA | |
| D. | 含1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA |
分析 A、求出氧气的物质的量,然后根据1mol氧气含16mol电子来分析;
B、NH4+是弱碱阳离子,在溶液中会水解;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体.
解答 解:A、8g氧气的物质的量为0.25mol,而1mol氧气含16mol电子,故0.25mol氧气中含4mol电子,故A正确;
B、NH4+是弱碱阳离子,在溶液中会水解,故溶液中NH4+的个数小于0.1NA个,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氯气的物质的量小于1mol,故转移的电子的物质的量小于2mol,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体,故1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得胶粒的个数小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
5.对于核电荷数为37的元素,下列描述正确的是( )
| A. | 某单质在常温下跟水反应不如钠剧烈 | |
| B. | 某碳酸盐易溶于水 | |
| C. | 其原子半径比钾原子半径小 | |
| D. | 某氢氧化物不能使Al(OH)3溶解 |
10.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的相对原子质量呈周期性变化 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
7.下列说法中肯定错误的是( )
| A. | 某原子K层上只有一个电子 | |
| B. | 某原子M层上电子数为L层电子数的4倍 | |
| C. | 某离子M层上的电子数为K层的4倍 | |
| D. | 阴离子的最外层电子数可能为2,也可能为8 |
14.能与NaOH溶液反应的含共价键的化合物是( )
| A. | 金刚石 | B. | 晶体硅 | C. | 石英(SiO2) | D. | MgO |
11.下列叙述错误的是( )
| A. | 在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) | |
| D. | 常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍已知:KSP[Cd(OH)2]=7.2×10-15,KSP[Co(OH)2]=1.8×10-15 |
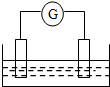 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: