题目内容
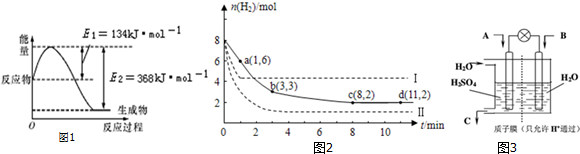
13.CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.(1)图1是在101kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图.
已知:①N2(g)+O2(g)=2NO (g)△H=179.5kJ•mol-1
②2NO (g)+O2(g)=2NO2(g)△H=-112.3kJ•mol-1
请写出NO与CO反应生成无污染气体的热化学方程式:2NO (g)+2CO (g)=N2(g)+2 CO2(g)△H=-759.8 kJ•mol-1.
(2)工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图2中实线所示(图中字母后的数字表示对应的坐标).
①该反应在0~8min内CO2的平均反应速率是0.125mol/(L•min);
②该反应的平衡常数表达式为:K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
③仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示.与实线相比,曲线Ⅰ改变的条件可能是升高温度,曲线Ⅱ改变的条件可能是增大压强.若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是K1<K=K2;
(3)有学者设想以如图3所示装置用电化学原理将他们转化为重要化工原料.请回答:
①若A为SO2,B为O2,C为H2SO4,则负极反应式SO2-2e-+2H2O=4H++SO42-;
②若A为CO2,B为H2,C为CH3OH,则正极反应式CO2+6H++6e-=CH3OH+H2O.
分析 (1)NO与CO反应生成无污染气体,发生反应为:2 NO+2 CO=N2+2 CO2,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,结合已知热化学方程式,利用盖斯定律书写目标热化学方程式;
(2)①由图可知,8min时氢气的物质的量为2mol,参加反应的氢气为8mol-2mol=6mol,根据v=$\frac{△c}{△t}$计算v(H2),再利用速率之比等于其化学计量数之比计算v(CO2);
②化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意固体、纯液体不需要写出;
③曲线I反应速率增大,但转化的氢气的物质的量少,改变条件平衡向逆反应方向移动,可能是升高温度,因该反应放热,升高温度平衡逆向移动;
曲线Ⅱ反应速率增大,转化的氢气的物质的量多,平衡正向移动,可能是增大压强;
平衡常数只受温度的影响,该反应放热,升高温度平衡逆向移动,平衡常数减小;
(3)①反应本质是:SO2+O2+H2O=H2SO4,负极发生氧化反应,二氧化硫在负极失去电子与水生成硫酸根、氢离子;
②正极发生还原反应,通入的二氧化碳转化为甲醇,由电荷守恒可知,应有氢离子参加反应.
解答 解:(1)NO与CO反应生成无污染气体,发生反应为:2 NO+2 CO=N2+2 CO2,
已知:①N2(g)+O2(g)=2NO (g)△H=179.5kJ•mol-1
②2NO (g)+O2(g)=2NO2(g)△H=-112.3kJ•mol-1
由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,该反应热化学方程式为③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,
根据盖斯定律可知,③×2+②-①得:2 NO (g)+2 CO (g)=N2(g)+2 CO2(g)△H=-759.8 kJ•mol-1,
故答案为:2 NO (g)+2 CO (g)=N2(g)+2 CO2(g)△H=-759.8 kJ•mol-1;
(2)①由图可知,8min时氢气的物质的量为2mol,参加反应的氢气为8mol-2mol=6mol,故v(H2)=$\frac{\frac{6mol}{2L}}{8min}$=0.375mol/(L•min),速率之比等于化学计量数之比,故v(CO2)=$\frac{1}{3}$v(H2)=$\frac{1}{3}$×0.375mol/(L•min)=0.125mol/(L•min),
故答案为:0.125mol/(L•min);
②反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$,故答案为:$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
③曲线I反应速率增大,但转化的氢气的物质的量少,可能是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化;
曲线Ⅱ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强;
平衡常数只受温度的影响,该反应放热,升高温度平衡逆向移动,平衡常数减小,故温度越高平衡常数越小,曲线Ⅰ温度最高,实线和曲线Ⅱ温度相同,故K1<K=K2,
故答案为:升高温度; 增大压强;K1<K=K2;
(3)①反应本质是:SO2+O2+H2O=H2SO4,负极发生氧化反应,二氧化硫在负极失去电子与水生成硫酸根、氢离子,负极电极反应式为:SO2-2e-+2H2O=4H++SO42-,
故答案为:SO2-2e-+2H2O=4H++SO42-;
②正极发生还原反应,通入的二氧化碳转化为甲醇,由电荷守恒可知,应有氢离子参加反应,正极电极反应式为:CO2+6H++6e-=CH3OH+H2O,
故答案为:CO2+6H++6e-=CH3OH+H2O.
点评 本题属于拼合型题目,涉及热化学方程式书写、化学反应速率计算、化学平衡常数、化学平衡图象、原电池等,是对学生综合能力的考查,需要学生熟练掌握基础知识,难度中等.

| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 非极性键只存在于双原子分子中 | |
| D. | 含有共价键的化合物都是共价键化合物 |
| A. | 2mol甲醇参加反应,放出的热量为25kJ | |
| B. | 浓硫酸在反应中只作催化剂 | |
| C. | 2υ(CH3OH)=υ(CH3OCH3) | |
| D. | 升高温度或增大压强均可加快反应速率 |
| A. | 此装置可以实现Cl2的制取、收集、尾气吸收 | |
| B. | 此装置可以实现乙酸乙酯的制取和收集 | |
| C. | 此装置可以形成Cu-Zn原电池 | |
| D. | 此装置可证明H2CO3酸性大于H2SiO3 |
| A. | 常温常压下,8 g O2含有电子数目为4NA | |
| B. | 1 L 0.1mol/L的氯化铵溶液中NH4+的数目为0.1NA | |
| C. | 常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA | |
| D. | 含1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA |
| A. | 胶体与其他分散系的本质区别是丁达尔效应 | |
| B. | 氨气属于非电解质,Cu属于电解质 | |
| C. | Na2CO3溶液显碱性,说明Na2CO3属于碱 | |
| D. | 二氧化碳和二氧化硫都是酸性氧化物 |
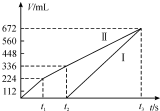 常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)