题目内容
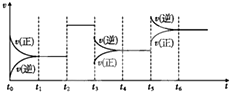 某密闭容器中发生反应:X(g)+Y(g)?3Z(g)△H<0如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生反应:X(g)+Y(g)?3Z(g)△H<0如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A、t2时加入了催化剂 |
| B、t3时降低了温度 |
| C、t5时增大了压强 |
| D、t4~t5时间内转化率最低 |
考点:化学反应速率变化曲线及其应用
专题:化学平衡专题
分析:由X(g)+Y(g)?3Z(g)△H<0可知该反应是反应前后气体的物质的量不相等的反应,为放热反应,根据催化剂、温度、压强对化学反应速率和化学平衡的影响来分析,若化学平衡逆向移动,则反应物的转化率降低.
解答:
解:A、因该反应是反应前后气体的物质的量不相等的反应,t2~t3时间内正逆反应速率增大且相等,则应为t2时加入了催化剂,故A正确;
B、由图可知,t3时正逆反应速率都减小,且逆反应速率大于正反应速率,化学平衡在t3时向逆反应方向移动,而该反应为放热反应,降低温度化学平衡正向移动,故B错误;
C、t5时正逆反应速率都增大,且逆反应速率大于正反应速率,化学平衡在t5时向逆反应方向移动,由化学计量数可知,增大压强,化学平衡应逆向移动,故C正确;
D、由图可知,t4~t5时间内v不变,化学反应处于平衡状态,平衡不移动,则反应物的转化率不变,t5~t6时间内X或Y的转化率最低,故D错误;
故选AC.
B、由图可知,t3时正逆反应速率都减小,且逆反应速率大于正反应速率,化学平衡在t3时向逆反应方向移动,而该反应为放热反应,降低温度化学平衡正向移动,故B错误;
C、t5时正逆反应速率都增大,且逆反应速率大于正反应速率,化学平衡在t5时向逆反应方向移动,由化学计量数可知,增大压强,化学平衡应逆向移动,故C正确;
D、由图可知,t4~t5时间内v不变,化学反应处于平衡状态,平衡不移动,则反应物的转化率不变,t5~t6时间内X或Y的转化率最低,故D错误;
故选AC.
点评:本题为图象题,明确图象中纵横左标的含义,利用反应速率的关系及化学平衡移动结合化学反应速率和化学平衡的影响因素即可解答.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
实验室制备,收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器口顺序为a接( )接( )接( )接( )接f(填接口字母)( )


| A、b c d e |
| B、d e b c |
| C、d e c b |
| D、e d b c |
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(g)+3B(g)?2C(g)+D(g) 已达平衡状态的是( )
| A、混合气体的压强不随时间变化 |
| B、B的生成速率和D的生成速率1:1 |
| C、混合气体的密度不随时间变化 |
| D、D的分子数之比为3:2:1. |
除去镁粉中含有的杂质铝粉可选用的溶液是( )
| A、硫酸 | B、氢氧化钠 |
| C、氨水 | D、氯化铜 |
M、N为短周期的两种元素,M元素原子的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其中说法正确的是( )
| A、M、N可能为金属 |
| B、若M、N为同周期元素,则原子半径M<N |
| C、M、N元素的单质可能与水发生置换反应 |
| D、M、N形成的离子化合物不能体现强氧化性 |
下列工业制备的反应原理选择不恰当的是( )
A、制乙醇:CH3CHO+H2
| ||||
B、制盐酸:H2+Cl2
| ||||
C、制烧碱:2NaCl+2H2O
| ||||
| D、湿法冶炼铜:Fe+CuSO4=Cu+FeSO4 |
下列实验方案合理的是( )
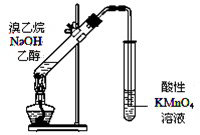

| A、鉴别苯和甲苯:分别加入溴水振荡 |
| B、检验酒精中的少量水:向酒精中加入无水硫酸铜 |
| C、制备纯净的氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D、证明溴乙烷与NaOH醇溶液共热生成乙烯:用如图所示的实验装置 |
12.8g铜跟适量的浓硝酸反应,铜完全作用后,共收集到气体5.6L(标准状况),反应消耗HNO3的物质的量可能是( )
| A、0.25mol |
| B、1.0mol |
| C、0.65mol |
| D、0.5mol |