题目内容
5.根据下列转化关系,回答有关问题.
(1)浅绿色溶液D主要成分的化学式为FeCl2.
(2)试剂1是c,试剂2是b(填字母).
a.铁 b.氯水 c.硫氰化钾 d.氢氧化钠
(3)往D溶液中滴加氢氧化钠溶液,现象先生成白色絮状沉淀,后迅速变成灰绿色,最后变成红褐色,发生反应的化学方程式FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+2H2O+O2=4Fe(OH)3.
(4)铁与水蒸汽反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
分析 Fe与稀HCl反应生成氯化亚铁溶液呈浅绿色,则D为FeCl2,浅绿色D加试剂2生成棕黄色溶液E,是亚铁离子被氧化剂氧化为铁离子,则试剂2具有氧化性,棕黄色溶液E含有三价铁离子,加试剂1生成深红色的溶液F,则试剂1为KSCN溶液;Fe在高温下与水蒸气反应生成四氧化三铁和氢气,则A为Fe3O4,四氧化三铁与盐酸反应生成棕黄色溶液B为氯化亚铁和氯化铁,棕黄色溶液B加试剂1KSCN溶液生成淡红色溶液C,淡红色溶液C再加试剂2生成深红色的溶液F,则F为Fe(SCN)3.
(1)Fe与稀HCl反应生成氯化亚铁溶液呈浅绿色;
(2)Fe在高温下与水蒸气反应生成四氧化三铁,四氧化三铁与盐酸反应生成氯化亚铁和氯化铁,三价铁离子遇KSCN溶液显红色;亚铁离子被氧化剂氧化为铁离子呈棕黄色;
(3)浅绿色溶液D主要成分的化学式为FeCl2,则滴加氢氧化钠溶液,先生成白色絮状的Fe(OH)2沉淀,后迅速被氧气氧化变成灰绿色,最后变成红褐色的Fe(OH)3沉淀;
(4)Fe在高温下与水蒸气反应生成四氧化三铁和氢气.
解答 解:(1)Fe与HCl反应生成氯化亚铁溶液,亚铁离子的溶液显浅绿色,则浅绿色溶液D主要成分的化学式为FeCl2;故答案为:FeCl2;
(2)Fe在高温下与水蒸气反应生成四氧化三铁,四氧化三铁与盐酸反应生成氯化亚铁和氯化铁,三价铁离子遇KSCN溶液显红色,所以试剂1是硫氰化钾;
浅绿色溶液D转化为棕黄色溶液E,是亚铁离子被氧化剂氧化为铁离子,选择氧化性大于铁离子的物质,所以试剂2选氯水;故答案为:c;b;
(3)浅绿色溶液D主要成分的化学式为FeCl2,则滴加氢氧化钠溶液,先生成白色絮状的Fe(OH)2沉淀,后迅速被氧气氧化变成灰绿色,最后变成红褐色的Fe(OH)3沉淀,发生反应的化学方程式为FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:先生成白色絮状沉淀,后迅速变成灰绿色,最后变成红褐色;FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(4)Fe在高温下与水蒸气反应生成四氧化三铁和氢气,反应化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题考查了元素化合物性质与转化、离子检验,熟练掌握元素化合物的性质以及铁离子的检验方法是解题关键,题目难度不大,侧重于考查学生的分析能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数 | |
| B. | 对于有气体参加的化学反应,若增大压强,可增大活化分子的百分数 | |
| C. | 升高温度,可以增大活化分子百分数 | |
| D. | 活化分子间的碰撞一定是有效碰撞 |
| A. | 铝锂合金的硬度大于纯铝、熔点低于锂单质 | |
| B. | 改变原料的配比,可以制得性能不同的铝锂合金 | |
| C. | 铝锂合金的性质与各成分金属的性质完全相同 | |
| D. | 铝锂合金优点是密度较小、强度较大 |
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Fe3+ |
①2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O
②KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O
如果上述两个反应所产生的氯气质量相等,被氧化的还原剂的物质的量之比为( )
| A. | 8:5 | B. | 6:5 | C. | 2:1 | D. | 1:1 |
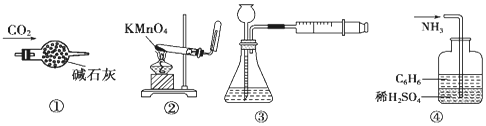
| A. | 装置①:干燥CO2 | B. | 装置②:实验室制取并收集O2 | ||
| C. | 装置③:装置气密性的检查 | D. | 装置④:吸收NH3 |
| A. | Na+、NO3- | B. | S2-、AlO2- | C. | Al3+、Fe3+ | D. | MnO4-、NH4+ |
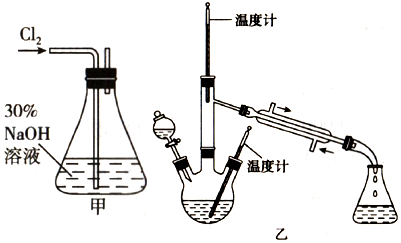 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):