题目内容
12.用铝片和稀硫酸反应制取氢气时,下列做法能加快化学反应速率的是(| A. | 用98%的浓硫酸替代稀硫酸 | B. | 降低温度 | ||
| C. | 用铝粉代替铝片 | D. | 加入Na2SO4溶液 |
分析 用铝片与稀硫酸反应制氢气时,适当增大稀硫酸浓度、升高温度、增大反应物接触面积都可以加快反应速率,以此解答该题.
解答 解:A.常温下浓硫酸和铝片发生钝化现象,且反应生成二氧化硫而不是氢气,故A错误;
B.降低温度,反应速率减小,故B错误;
C.用铝粉代替铝片增大反应物接触面积,所以反应速率增大,故C正确;
D.加入Na2SO4溶液,溶液体积增大,浓度减小,反应速率减小,故D错误.
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,明确化学反应速率影响原理是解本题关键,易错选项是A,注意浓硫酸的性质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列有机物中,是烷烃同系物的是( )
| A. | C5H10 | B. | C3H8 | C. | C2H2 | D. | C6H6 |
20.下列有机物属于烷烃的是( )
| A. | C2H4 | B. | C4H6 | C. | C3H8 | D. | C6H6 |
17.将20g Ba(OH)2•8H2O晶体与10g NH4Cl晶体一起放入小烧杯中,并将烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌晶体.则下列说法正确的是( )
| A. | 实验中玻璃棒的作用是加速固体溶解 | |
| B. | 玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应 | |
| C. | 反应中断开化学键吸收的总能量低于形成化学键放出的总能量 | |
| D. | 该反应中,反应物的总能量小于生成物的总能量 |
4.铜锌原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
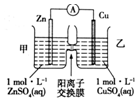

| A. | 锌电极上发生的反应: | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 电流由锌电极经电流表流向铜电极 | |
| D. | 电池工作一段时间后,乙池溶液的总质量增加 |
1.将H2SO4,Na2CO3,Ba(OH)2三种溶液,两两混合后,恰好完全反应,对有沉淀生成的分别进行过滤,所得滤液的酸碱性叙述正确的是( )
| A. | 一种滤液显碱性,另一种滤液显中性 | |
| B. | 两种滤液均显碱性 | |
| C. | 一种滤液显碱性,另一种滤液显酸性 | |
| D. | 两种滤液均显酸性 |
2.100ml浓度为2mol•L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入少量浓盐酸 | B. | 加入几滴氯化铜溶液 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |