题目内容
金属镁溶于很稀的硝酸溶液,生成硝酸镁、硝酸铵和水.反应的镁和HNO3物质的量之比是( )
| A、3:8 | B、1:4 |
| C、2:5 | D、4:1 |
考点:化学方程式的有关计算
专题:计算题
分析:根据电子转移守恒计算n(NH4NO3),根据氮元素守恒:n反应(HNO3)=2n[Mg(NO3)2]+2n(NH4NO3).
解答:
解:有1molMg反应生成1mol硝酸镁,根据电子转移守恒,n(NH4NO3)=
=0.25mol,
根据氮元素守恒:n反应(HNO3)=2n[Mg(NO3)2]+2n(NH4NO3)=2×1mol+2×0.25mol=2.5mol,
反应的镁和HNO3物质的量之比是为1mol:2.5mol=2:5,
故选C.
| 1mol×2 |
| [5-(-3)] |
根据氮元素守恒:n反应(HNO3)=2n[Mg(NO3)2]+2n(NH4NO3)=2×1mol+2×0.25mol=2.5mol,
反应的镁和HNO3物质的量之比是为1mol:2.5mol=2:5,
故选C.
点评:本题考查氧化还原反应计算,注意利用守恒思想进行解答,也可以配平方程式进行计算,难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
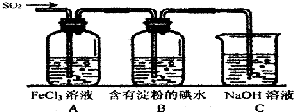 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示: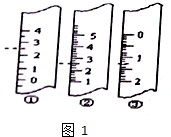 中用水稀释后转移到100mL容量瓶中定容,然后将稀释后的溶液倒入试剂瓶中.
中用水稀释后转移到100mL容量瓶中定容,然后将稀释后的溶液倒入试剂瓶中.