题目内容
下列叙述正确的是( )
A、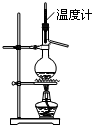 实验室用图所示装置制取乙烯 |
| B、由水电离出的c(H+)=10-13mol?L-1的溶液中,Na+、ClO-、K+、I-一定能大量共存 |
| C、肥皂的主要成分是高级脂肪酸盐 |
| D、某温度下Fe(OH)3的KSP=4×10-38,则该温度下,饱和溶液的c(OH-)=2×10-19 mol?L-1 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,离子共存问题,乙烯的实验室制法
专题:
分析:A、实验室制取乙烯时,温度计水银球应插入液面下;
B、次氯酸根离子能够氧化碘离子;
C、肥皂的主要成分是高级脂肪酸钠;
D、Fe(OH)3的KSP=4×10-38,说明氢氧化铁几乎不溶于水,其pH接近与7.
B、次氯酸根离子能够氧化碘离子;
C、肥皂的主要成分是高级脂肪酸钠;
D、Fe(OH)3的KSP=4×10-38,说明氢氧化铁几乎不溶于水,其pH接近与7.
解答:
解:A、实验室制取乙烯时,温度计水银球应插入液面下,故A错误;
B、次氯酸根离子能够氧化碘离子,所以Na+、ClO-、K+、I-一定不能能大量共存,故B错误;
C、肥皂的主要成分是高级脂肪酸钠,故C正确;
D、Fe(OH)3的KSP=4×10-38,说明氢氧化铁几乎不溶于水,其pH接近与7,c(OH-)接近于2×10-7 mol?L-1,故D错误;
故选C.
B、次氯酸根离子能够氧化碘离子,所以Na+、ClO-、K+、I-一定不能能大量共存,故B错误;
C、肥皂的主要成分是高级脂肪酸钠,故C正确;
D、Fe(OH)3的KSP=4×10-38,说明氢氧化铁几乎不溶于水,其pH接近与7,c(OH-)接近于2×10-7 mol?L-1,故D错误;
故选C.
点评:本题考查了实验室制乙烯、氧化还原反应、溶度积,题目难度中等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
下列有关说法不正确的是( )
| A、常温下,PbSO4易溶于pH=7的CH3COONH4溶液,说明(CH3COO)2Pb是弱电解质 |
| B、向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4) |
| C、潜艇上的核反应堆使用液态铝-钠合金作载热介质,若合金中n(Na)>n(Al),将其投入到足量的水中可得无色透明溶液 |
| D、向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-═I2+I- |
下列关于粗盐提纯说法正确的是( )
| A、溶解粗盐时,应尽量使溶液稀些,以保证食盐完全溶解 |
| B、滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 |
| C、当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D、将制得的晶体转移到新制过滤器中用大量蒸馏水进行洗涤 |
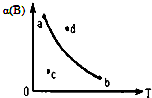 条件一定时,反应2A(g)+B(g)?2C(g),B的转化率α与温度T变化关系曲线图如图所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是( )
条件一定时,反应2A(g)+B(g)?2C(g),B的转化率α与温度T变化关系曲线图如图所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是( ) 氯是一种非常重要的非金属元素.
氯是一种非常重要的非金属元素.