题目内容
17.下列变化过程中,属于放热反应的有:②③①水蒸气变成液态水 ②生石灰与水反应
③酸碱中和反应 ④Ba(OH)2•8H2O与NH4Cl晶体的反应.
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化、某些复分解(如铵盐和强碱),以此解答该题.
解答 解:①放热反应首先为化学变化,水蒸气变成液态水为物理变化,不属于放热反应,故错误;
②生石灰与水反应,放出大量的热,为放热反应,故正确;
③酸碱中和反应为放热反应,故正确;
④Ba(OH)2•8H2O与NH4Cl晶体的反应为吸热反应,故错误.
故答案为:②③.
点评 本题考查化学反应中能量变化,为高频考点,侧重于双基的考查,有利于培养学生良好的科学素养,提高学习的积极性,题目难度不大,注意常见的放热反应和吸热反应.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
8.(1)与标准状况下4.48L CO2中所含氧原子数目相同的水的质量是7.2g;
(2)V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为$\frac{3m}{112V}$mol/L;
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则x的数值为2;
(4)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为24.5L/mol,气体所处的条件不是(填“是”或“不是”)标准状况.
(5)下列是常用的中和胃酸的药物:
估算10片胃舒平和5片达喜,含铝的物质的量较多的是10片胃舒平.
(2)V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为$\frac{3m}{112V}$mol/L;
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则x的数值为2;
(4)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为24.5L/mol,气体所处的条件不是(填“是”或“不是”)标准状况.
(5)下列是常用的中和胃酸的药物:
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成份的药量 | 0.245g | 0.5g |
5.(1)写出H2C2O4与KMnO4酸性溶液反应的化学方程式.5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O
(2)若要测定此反应的化学反应速率,最方便的测定方法是测定溶液紫红色褪色时间;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥$\frac{5}{2}$.
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
(2)若要测定此反应的化学反应速率,最方便的测定方法是测定溶液紫红色褪色时间;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥$\frac{5}{2}$.
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
| 编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
| ① | 2 | 4 | 2 | 25 |
| ② | 3 | |||
| ③ | 50 |
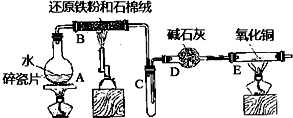
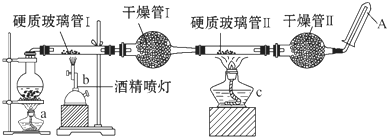 在常温下,Fe与水并不起反应,但在高温下,Fe可与水蒸气发生反应.应用下列装置,试探究反应的部分产物.在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物
在常温下,Fe与水并不起反应,但在高温下,Fe可与水蒸气发生反应.应用下列装置,试探究反应的部分产物.在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物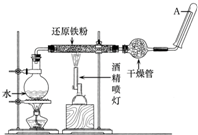 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.