题目内容
19.已知:3H2O2+1Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O(1)配平该方程式,并用单线桥法表示电子转移情况
 .
.(2)此反应中氧化剂是H2O2.
(3)若消耗1mol•L-1Cr2(SO4)3溶液的体积为50mL,则转移电子的物质的量是0.3mol.
分析 (1)根据氧化还原反应中得失电子数相等配平方程式,单线桥是指从失去电子的一方指向得到电子的一方,上面标注电子转移总数,此反应中铬元素化合价+3价变化为+4价,被氧化电子转移6e-;
(2)元素化合价降低的反应物做氧化剂被还原,元素化合价升高的反应物做还原剂被氧化;
(3)据3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O~6mole-,计算消耗50mL,1mol•L-1Cr2(SO4)3溶液中电子转移的数目.
解答 解:(1)一个双氧水分子参加氧化还原反应时得2个电子,一个铬离子参加氧化还原反应失去3个电子,所以得失电子的最小公倍数是6,则双氧水的计量数是3,铬离子的计量数是1,然后根据原子守恒配平其它原子,所以方程式3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O,故系数是3,1,10,2,3,8;单线桥是指从失去电子的一方指向得到电子的一方,上面标注电子转移总数,此反应中铬元素化合价+3价变化为+4价,被氧化电子转移6e-,用单线桥表示出该反应中电子转移的方向和数目的化学方程式为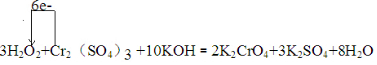 ,
,
故答案为:3;1;10;2;3;8;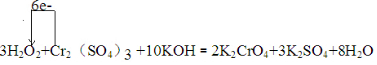 ;
;
(2)元素化合价降低的反应物做氧化剂被还原,其中H2O2中O元素化合价由-1降低到-2,故H2O2是氧化剂,
故答案为:H2O2;
(3)3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O~6mole-
1 6
1×0.05 0.3
故答案为:0.3mol.
点评 本题考查了氧化还原反应,侧重于氧化还原反应基本概念和电子转移的考查,注意掌握基本概念实质和规律的应用是解题关键,题目难度不大.

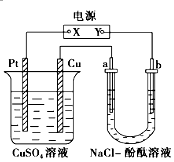 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色.下列说法正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色.下列说法正确的是( )①X是正极,Y是负极 ②a是阴极,b是阳极
③CuSO4溶液的pH值逐渐减小 ④NaCl溶液的pH减小.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
| A. | CO32-向正极移动 | |
| B. | 负极发生的电极反应是:O2+2CO2+4e-═2CO32- | |
| C. | 负极发生的电极反应是:CO+CO32--2e-═2CO2 | |
| D. | 正极发生氧化反应 |
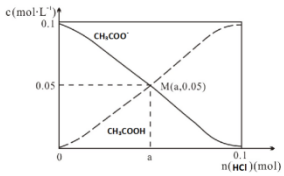
| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(H+)-n(OH-)=(0.05-a )mol | |
| C. | 随着HCl的加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}COO{H}^{-})}$不断减小 | |
| D. | 当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+) |
| 实验A | 条件 | 现象 |
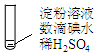 | 加热 | ⅰ.加热后蓝色褪去 ⅱ.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
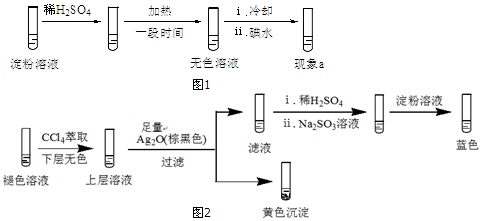
(2)分析现象ⅰ、ⅱ认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动.设计实验如图1,“现象a”证实该分析不合理:“现象a”是溶液不变蓝.
(3)再次分析:加热后单质碘发生了变化,实验如下:
Ⅰ:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝.
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝.
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释解释1:6H++5I-+IO3-═3I2+3H2O,解释2:4H++4I-+O2═2I2+2H2O,解释3:2H++2I-+IO-═I2+H2O.
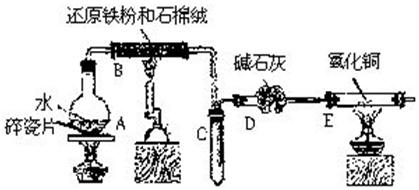
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如图2实验:
①产生黄色沉淀的离子方程式是2H++2I-+Ag2O═2AgI↓+H2O.
②Ag2O的作用是证明上层溶液中存在I-,沉淀I-,排除向滤液中加入稀H2SO4后,因I-被氧化生成I2的可能.
③依据上述实验,推测滤液中含有的物质(或离子)可能是HIO(或IO-)、HIO3(或IO3-)、H+.
(5)结合化学反应速率解释实验A中现象ⅰ、现象ⅲ蓝色褪去的原因现象ⅰ:部分I2挥发,部分I2与H2O发生反应;现象ⅲ:淀粉完全水解.加热时,I2与H2O的反应速率大于淀粉水解的速率.