题目内容
11.将钠投入到滴有石蕊试液的水中,下列有关现象的叙述中,错误的是( )| A. | 钠浮在水面上 | B. | 钠熔化成小球并在水面上游动 | ||
| C. | 有无色无味的气体生成 | D. | 水溶液变为红色 |
分析 钠的密度小于水,钠的熔点较低,钠和水剧烈反应生成氢氧化钠和氢气,且反应放出大量的热,氢氧化钠溶液呈碱性,紫色石蕊试液遇碱变蓝色,据此解答.
解答 解:钠的密度小于水,钠的熔点较低,钠和水剧烈反应生成氢氧化钠和氢气,且反应放出大量的热,熔化成小球并在水面上游动,氢氧化钠溶液呈碱性,紫色石蕊试液遇碱变蓝色,
故选:D.
点评 本题考查了钠与水反应的现象,熟悉钠的物理性质、化学性质是解题关键,题目简单.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
1.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生不相关 |
2.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 NaOH H2O |
6.下列图象能正确反映对应的实验操作的是( )
| A. |  向一定量的饱和石灰水中加入氧化钙 | |
| B. |  加热一定量高锰酸钾固体产生氧气 | |
| C. |  用一定量的双氧水制取氧气 | |
| D. |  向一定量的硝酸银溶液中插入铜丝 |
16.将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )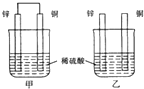

| A. | 两烧杯中溶液的pH均增大 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲、乙溶液均变蓝色 |
3.在水溶液中能大量共存,且加入过量稀硫酸溶液时,有气体生成的是( )
| A. | Na+ Ag+ CO32- Cl- | B. | K+ Ba2+SO42- Cl- | ||
| C. | Na+ K+ CO32- Cl- | D. | Na+ K+ Cl- SO42- |


 .
.