题目内容
8.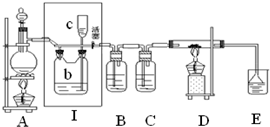 如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(碘化钾淀粉溶液),C(水),E(NaOH溶液).
如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(碘化钾淀粉溶液),C(水),E(NaOH溶液).(1)A是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其化学反应的化学方程式是:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃D处酒精灯,请写出B中的现象溶液变蓝.
(3)在D装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使E处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,写出D中反应的化学方程式C+2H2O+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4HCl↑.
(4)E装置的作用是吸收过量的氯气和生成的氯化氢,防止空气污染.
(5)如E装置中是滴有酚酞的NaOH溶液,结果红色会退去,可能的原因是可能是盐酸与氢氧化钠发生酸碱中和,也可能是氯气与水反应生成的次氯酸的漂白性造成
(6)D处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时Ⅰ处应该怎样操作关闭Ⅰ处活塞.
(7)若将C中的水换成氢氧化钠溶液,溶液中不但有NaClO还有NaClO3,其物质的量比为2:1,则氧化剂和还原剂的物质的量比为:7:3.
(8)氯碱工业制备氯气的反应方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰和氯气、水;
(2)B中是碘化钾淀粉溶液,氯气会氧化碘离子为单质碘;
(3)依据通入的气体有氯气、玻璃管中是碳,利用C中提供的水蒸气反应生成氯化氢和二氧化碳;
(4)氯气有毒,容易造成空气污染;
(5)依据酚酞遇到碱变红色,次氯酸具有漂白性解答;
(6)反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,可以利用Ⅰ装置进行储气,把装置Ⅰ中的活塞关闭;
(7)C换成氢氧化钠溶液,氯气和氢氧化钠反应生成次氯酸钠、氯酸钠和水,依据氧化还原反应判断产物还有氯化钠,结合电子守恒书写配平化学方程式计算得到;
(8)工业制氯气可以用电解饱和食盐水的方法生成.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰和氯气、水,化学方程式:MnO2+4HCl (浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl (浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(2)B中是碘化钾淀粉溶液,氯气会氧化碘离子为单质碘;单质碘遇淀粉变蓝;
故答案为:溶液变蓝;
(3)硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使E处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,说明生成氯化氢和二氧化碳,证明C是提供水蒸气的主要,碳、氯气和水蒸气反应生成氯化氢和二氧化碳,反应的化学方程式为:C+2H2O+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl,
故答案为:C+2H2O+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4HCl↑;
(4)氯气有毒,容易造成空气污染,可以用氢氧化钠溶液吸收过量的氯气和生成的氯化氢,防止空气污染;
故答案为:吸收过量的氯气和生成的氯化氢,防止空气污染;
(5)酚酞遇到碱变红色,次氯酸具有漂白性,进入E的气体中含有氯化氢和氯气,氯化氢能够与氢氧化钠反应,降低溶液碱性,氯气能够与水反应生成次氯酸,次氯酸具有漂白性,所以溶液褪色原因:可能是盐酸与氢氧化钠发生酸碱中和,也可能是氯气与水反应生成的次氯酸的漂白性造成;
故答案为:可能是盐酸与氢氧化钠发生酸碱中和,也可能是氯气与水反应生成的次氯酸的漂白性造成;
(6)反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,可以利用Ⅰ装置进行储气,把装置Ⅰ中的活塞关闭;
故答案为:关闭Ⅰ处活塞;
(7)C中的水换成氢氧化钠溶液,溶液中不但有NaClO还有NaClO3,其物质的量比为2:1,依据氧化还原反应中:氯元素化合价升高,Cl2~2NaClO~2e-;Cl2~NaClO3~5e-,氯元素化合价降低,Cl2~Cl-~e-,依据电子守恒得到,电子转移7mol电子,所以做氧化剂的氯气为7mol,还原剂为3mol,所以参加反应的氧化剂和还原剂的物质的量比为7:3,
故答案为:7:3;
(8)工业制氯气可以用电解饱和食盐水的方法生成;依据电极氯化钠溶液生成氢氧化钠、氢气、氯气;依据原子守恒配平化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
点评 本题考查了氯气实验室制备,氯气性质验证和除杂方法,反应产物判断,氧化还原反应电子守恒的计算应用和反应分析,题目难度较大,熟悉氯气制备原理及性质是解题关键.

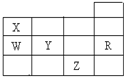 如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | 元素原子半径:W<Y | |
| B. | X、Y的阴离子电子层结构都与R原子相同 | |
| C. | Y元素的非金属性比W元素的非金属性强 | |
| D. | 常温常压下五种元素的单质中,Z单质的沸点最高 |
| A. | 萃取操作中,分液漏斗振摇后需要放气,放气的具体操作为,将分液漏斗置于铁架台的铁圈上,打开上口玻璃塞 | |
| B. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| C. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其的反应速率 | |
| D. | 用洁净的玻璃棒蘸取新制氯水,滴在pH 试纸上,然后与比色卡对照,可测定新制氯水的pH 值 |
| A. | a>b>c | B. | a>c>b | C. | a=b+m+n | D. | a=c-n-m |
| A. | IBr可能是一种有色物质 | |
| B. | 在许多反应中IBr是强氧化剂 | |
| C. | 在IBr与水的反应中,IBr既是氧化剂又是还原剂 | |
| D. | 与NaOH溶液反应有NaIO生成 |
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶、烧杯外还需要的其它玻璃仪器 |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻线2-3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶.
(4)若出现如下情况,对所配溶液浓度将有何影响?(填偏大、偏小、不变),没有进行A操作时浓度偏小;加蒸馏水时不慎超过了刻度线时浓度偏小;定容时俯视时浓度偏大.

下列有关这些操作的叙述中,不正确的是( )
| A. | 操作①中玻璃棒的作用是加快固体溶解速度 | |
| B. | 取操作2的溶液于试管中,滴加适量氢氧化钠稀溶液,并用湿润的红色石蕊试纸放于试管口,发现试纸变蓝,可以证明有NH4Cl的存在 | |
| C. | 操作③中盛放药品的仪器是坩埚 | |
| D. | 操作④的目的是检验MnO2的存在 |
①0.5mol氨气 ②标况下22.4L氦气 ③4℃时9mL水 ④0.2mol磷酸(H3PO4)
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①②④③ |
 (或
(或 ).
).