题目内容
17.一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,该反应在某密闭容器中达到平衡.下列分析正确的是( )| A. | 恒温恒容时,充入CO气体,达到新平衡时$\frac{c(C{O}_{2})}{c(CO)}$增大 | |
| B. | 容积不变时,升高温度,混合气体的平均相对分子质量减小 | |
| C. | 恒温恒容时,分离出部分SO2气体可提高MgSO4的转化率 | |
| D. | 恒温时,增大压强平衡逆向移动,平衡常数减小 |
分析 A.恒温恒容时,充入CO气体,相当于增大压强;
B.升高温度,平衡正向移动;
C.分离出部分SO2气体,可使平衡正向移动;
D.平衡常数只与温度有关.
解答 解:A.恒温恒容时,充入CO气体,相当于增大压强,则平衡逆向移动,达到新平衡时$\frac{c(C{O}_{2})}{c(CO)}$减小,故A错误;
B.升高温度,平衡正向移动,混合气体的平均相对分子质量增大,故B错误;
C.分离出部分SO2气体,可使平衡正向移动,则可提高MgSO4的转化率,故C正确;
D.平衡常数只与温度有关,改变压强,平衡常数不变,故D错误.
故选C.
点评 本题主要考查了平衡移动的影响因素和平衡状态的判断,为高频考点,侧重于学生的分析能力的考查,难度不大,解题时要注意勒夏特列原理的灵活运用.

练习册系列答案
相关题目
8.下列物质属于非电解质的是( )
| A. | 石墨 | B. | HCl | C. | CO2 | D. | BaCO3 |
5.下列说法正确的是( )
| A. | lmol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| B. | 苯的结构简式为 ,能使酸性高锰酸钾溶液褪色 ,能使酸性高锰酸钾溶液褪色 | |
| C. | 相同物质的量的乙烯与乙醇分别在足量的O2中完全燃烧,消耗O2的物质的量相同 | |
| D. | 乙烯和植物油都能使溴水褪色,其褪色原理不同 |
2.下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | 某温度下,pH=7的NH4Cl与NH3•H2O的混合溶液:c(NH4+)=c(Cl-)>c(H+)=c(OH-) | |
| B. | 0.1 mol/L Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)<c(Na+) | |
| D. | 0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) |
9.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | pH=l 的溶液中:Ba2+、Fe3+、Cl-、SCN- | |
| B. | 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液中:NH4+、Cu2+、NO3-、SO42- | |
| D. | 由水电离的c(H+)=10-12mol•L-1的溶液中:Na+、Al3+、Cl-、NO3- |
14.W、X、Y、Z、V五种主族元素,它们在周期表中的位置如表,W、X、Y、Z属于短周期元素,W的质子数为Y的两倍.下列说法不正确的是( )
| Y | |||
| Z | W | X | |
| V |
| A. | Y的最简单氢化物的沸点比W的最简单氢化物的沸点高 | |
| B. | X元素含氧酸的酸性强于W元素含氧酸的酸性 | |
| C. | 根据在周期表中的位置,可用推测V具有半导体特性 | |
| D. | X的单质在水溶液中可置换出W |
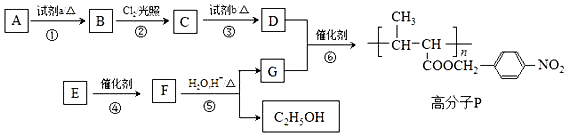
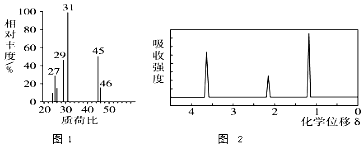
 +HO-NO2$→_{△}^{浓H_{2}SO_{4}}$
+HO-NO2$→_{△}^{浓H_{2}SO_{4}}$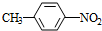 +H2O.
+H2O.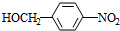 +
+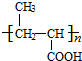 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +nH2O.
+nH2O.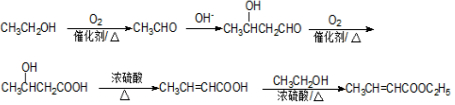 .
. )可由下列方法合成:
)可由下列方法合成:
 .B→C反应方程式为
.B→C反应方程式为 .
. ,
, .
. .
.