题目内容
2.下列叙述不正确的是( )| A. | 钠和钾的合金在常温下呈液态,通常用作原子反应堆的导热剂 | |
| B. | 氢的两种同位素氘和氚可用来作氢弹 | |
| C. | 为了观察氢气燃烧时的火焰颜色,可将玻璃导管换成石英管 | |
| D. | 56度的二锅头白酒中乙醇的质量分数为56% |
分析 A.钠与钾合金的熔点降低,导热性好,可作原子反应堆导热剂;
B.氢弹(又称热核武器),核武器的一种.主要利用氢的同位素(氘、氚)的聚变反应所释放的能量来进行杀伤破坏;
C.焰色反应是某些金属元素的性质,含有钠、钾、铜、等金属的材料在灼烧时有颜色,对氢气的燃烧观察产生干扰;
D.56度白酒是指乙醇的体积分数为56%;
解答 解:A.钠与钾合金的熔点降低,具有良好的导热、导电性,可作原子反应堆导热剂,故A正确;
B.氘,氚要求的条件低,不需要那么高的温度和压力,氢的两种同位素氘和氚可用来作氢弹,故B正确;
C.普通玻璃中含Na+和Fe2+、钾玻璃中含K+、铜管中含铜元素,做氢气燃烧实验时,燃气导管口中所含的金属钠(焰色反应为黄色)、钾(焰色反应隔着钴玻璃看是紫色)、铜(焰色反应为绿色)等产生的焰色反应会干扰观察氢气燃烧的火焰颜色,石英的成分是二氧化硅,在火焰下没有颜色,故最好选用石英玻璃,故C正确;
D.56度白酒是指乙醇的体积分数为56%,质量分数应用溶质乙醇质量除以溶液质量得到,故D错误;
故选D.
点评 本题考查了碱金属性质,与生活有关的化学知识,题目难度不大,注意常见化学知识的积累.

练习册系列答案
相关题目
12.下列能达到实验目的是( )
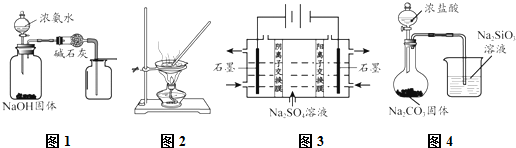

| A. | 用图1所示装置制取并收集干燥纯净的NH3 | |
| B. | 用图2所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 用图3所示装置制硫酸和氢氧化钠 | |
| D. | 用图4所示装置比较HCl、H2CO3和H2SiO3的酸性强弱 |
13.下列气体中,既可用浓硫酸干燥,又可用固体氢氧化钠干燥的是( )
| A. | Cl2 | B. | CO2 | C. | H2 | D. | NH3 |
17.下列事实不能用勒夏特列原理解释的是( )
| A. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| B. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| C. | 用排饱和食盐水法收集氯气 | |
| D. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
7.2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德•埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )


| A. | NO2是该过程的中间产物 | |
| B. | NO和O2必须在催化剂表面才能反应 | |
| C. | 汽车尾气的主要污染成分是CO2和NO | |
| D. | 该催化转化的总反应方程式为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2 |
14.在蒸发皿中加热蒸干并灼烧(低于 300℃)下列物质的溶液,可以得到该固体溶质的是( )
| A. | 氯化铝 | B. | 亚硫酸钠 | C. | 硫酸镁 | D. | 碳酸氢钠 |
11.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2 $\stackrel{催化剂}{→}$ CO2+H2O.下列有关说法正确的是( )
| A. | 该反应为吸热反应 | B. | CO2分子由极性键形成的极性分子 | ||
| C. | HCHO分子中有3个σ键,1个π键 | D. | 每生成1.8gH2O消耗2.24L O2 |
13.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是( )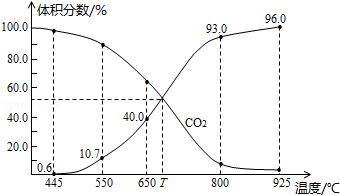
已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是( )

| A. | 550℃时,若充入惰性气体,v正,v逆均减小 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04P总 |