题目内容
12.下列能达到实验目的是( )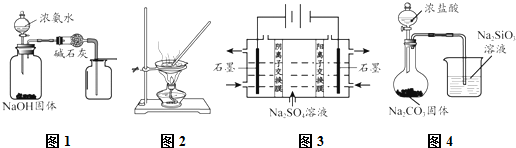
| A. | 用图1所示装置制取并收集干燥纯净的NH3 | |
| B. | 用图2所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 用图3所示装置制硫酸和氢氧化钠 | |
| D. | 用图4所示装置比较HCl、H2CO3和H2SiO3的酸性强弱 |
分析 A.氨气密度比空气小;
B.氯化铁在加热时水解生成氢氧化铁;
C.电解硫酸钠溶液,阴离子向阳极移动,阳离子向阴极移动;
D.盐酸易挥发,不能排除盐酸的干扰.
解答 解:A.氨气密度比空气小,应用向下排空气法收集,故A错误;
B.氯化铁在加热时水解生成氢氧化铁,不能直接用蒸发的方法制备,故B错误;
C.电解硫酸钠溶液,阴离子向阳极移动,在阳极上生成氧气和硫酸,阳离子向阴极移动,在阴极上生成氢气和氢氧化钠,故C正确;
D.盐酸易挥发,不能排除盐酸的干扰,应先通过饱和碳酸氢钠除去二氧化碳中的氯化氢,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的性质对比、制备和除杂等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握实验的原理和实验操作的严密性和可行性的评价,难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
2.下列叙述正确的是( )
| A. | 某溶液的pH<7,说明该溶液一定呈酸性 | |
| B. | 常温时pH=3的盐酸溶液与pH=5盐酸溶液等体积混合后溶液的pH=4 | |
| C. | 0.2 mol•L-1的盐酸,与等体积水混合后pH=1 | |
| D. | 常温时pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
3.轨道表示式是表示原子核外电子运动状态的一种化学用语,下列有关原子的最外层的轨道表示式正确的是( )
| A. | 铍原子 | B. | 碳原子 | ||
| C. | 氯原子 | D. | 铝原子 |
20.25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c(填序号).
a.CO32-b.ClO-c.CH3COO-d.HCO3-
(2)下列反应不能发生的是c、d(填序号).
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2CO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是b(填序号).
a.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ b.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ c.$\frac{c({H}^{+})}{{K}_{W}}$ d.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图1,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”,下同)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+).
(5)向20mL硫酸和盐酸的混合液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图2所示.
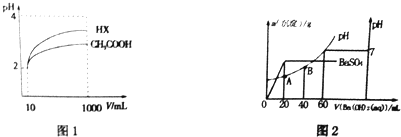
计算:①原混合溶液中c(H+)=0.3mol•L-1;c(Cl-)=0.2mol•L-1;
②A点的pH=1.
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c(填序号).
a.CO32-b.ClO-c.CH3COO-d.HCO3-
(2)下列反应不能发生的是c、d(填序号).
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2CO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是b(填序号).
a.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ b.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ c.$\frac{c({H}^{+})}{{K}_{W}}$ d.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图1,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”,下同)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+).
(5)向20mL硫酸和盐酸的混合液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图2所示.

计算:①原混合溶液中c(H+)=0.3mol•L-1;c(Cl-)=0.2mol•L-1;
②A点的pH=1.
7.2015年10月,中国科学家屠呦呦因为创制了新型抗疟药--青蒿素,获得诺贝尔生理学或医学奖.青蒿素可由香茅醛为原料制取,下列说法不正确的是( )
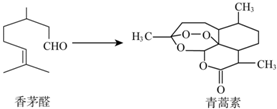

| A. | 香茅醛能使Br2的CCl4溶液褪色 | |
| B. | 青蒿素分子式为C15H22O5 | |
| C. | 青蒿素在一定条件下可发生水解反应 | |
| D. | 二者均可与氢气发生加成反应 |
17.下列有机物的系统命名中正确的是( )
| A. | 3-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 3-甲基-5-己烯 | D. | 3,3-二甲基-1-戊烯 |
1.关于酶的说法中不正确的是( )
| A. | 酶是蛋白质 | B. | 酶是激素 | ||
| C. | 酶是催化剂 | D. | 酶是高分子化合物 |
2.下列叙述不正确的是( )
| A. | 钠和钾的合金在常温下呈液态,通常用作原子反应堆的导热剂 | |
| B. | 氢的两种同位素氘和氚可用来作氢弹 | |
| C. | 为了观察氢气燃烧时的火焰颜色,可将玻璃导管换成石英管 | |
| D. | 56度的二锅头白酒中乙醇的质量分数为56% |

 +Br2→
+Br2→ .
.