题目内容
10.碳酸钠和碳酸氢钠是生活中常见的物质.请回答下列问题.(1)碳酸氢钠俗称小苏打,其水溶液显碱性.(填“酸”、“碱”或“中”).
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为HCO3-+H+=H2O+CO2↑.
等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成CO2的量,前者=后者(填“>”、“<”或“=”).
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
分析 (1)碳酸氢钠俗称小苏打,水溶液中碳酸氢根离子水解结合水电离出的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(2)碳酸氢钠和胃酸中的盐酸反应生成二氧化碳、水和氯化钠,等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成CO2的量依据碳元素守恒分析;
(3)碳酸氢钠固体受热分解,碳酸钠不分解.
解答 解:(1)碳酸氢钠俗称小苏打,水溶液中碳酸氢根离子水解结合水电离出的氢离子,促进水电离平衡正向进行,HCO3-+H2O?H2CO3+OH-,氢氧根离子浓度增大,溶液显碱性,
故答案为:小苏打;碱;
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,碳酸氢钠和胃酸中的盐酸反应生成二氧化碳、水和氯化钠,反应的离子方程式为HCO3-+H+=H2O+CO2↑,等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应,Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O,生成CO2的量相同,
故答案为:HCO3-+H+=H2O+CO2↑;=;
(3)除去碳酸钠固体中碳酸氢钠的反应是碳酸氢钠固体受热分解,碳酸钠不分解,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
点评 本题考查了钠及其化合物性质的应用,离子方程式书写,主要是碳酸钠和碳酸氢钠的性质比较,题目较简单.

练习册系列答案
相关题目
20.25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c(填序号).
a.CO32-b.ClO-c.CH3COO-d.HCO3-
(2)下列反应不能发生的是c、d(填序号).
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2CO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是b(填序号).
a.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ b.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ c.$\frac{c({H}^{+})}{{K}_{W}}$ d.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图1,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”,下同)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+).
(5)向20mL硫酸和盐酸的混合液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图2所示.
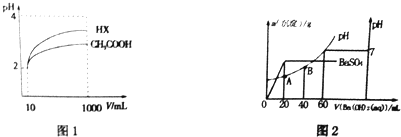
计算:①原混合溶液中c(H+)=0.3mol•L-1;c(Cl-)=0.2mol•L-1;
②A点的pH=1.
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c(填序号).
a.CO32-b.ClO-c.CH3COO-d.HCO3-
(2)下列反应不能发生的是c、d(填序号).
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2CO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是b(填序号).
a.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ b.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ c.$\frac{c({H}^{+})}{{K}_{W}}$ d.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图1,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”,下同)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+).
(5)向20mL硫酸和盐酸的混合液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图2所示.

计算:①原混合溶液中c(H+)=0.3mol•L-1;c(Cl-)=0.2mol•L-1;
②A点的pH=1.
1.关于酶的说法中不正确的是( )
| A. | 酶是蛋白质 | B. | 酶是激素 | ||
| C. | 酶是催化剂 | D. | 酶是高分子化合物 |
18.氢气是人类最理想的能源.已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,今有如下三个热化学方程式:
(1)H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=akJ/mol
(2)2H2(g)+O2(g)═2H2O(l)△H2=bkJ/mol
(3)H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H3=ckJ/mol
下列关于它们的表述正确的是( )
(1)H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=akJ/mol
(2)2H2(g)+O2(g)═2H2O(l)△H2=bkJ/mol
(3)H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H3=ckJ/mol
下列关于它们的表述正确的是( )
| A. | 2c=b | B. | c=+285.8 | ||
| C. | 通过原电池可以实现反应(3) | D. | 氢气的燃烧热为a kJ/mol |
5.下列化学式与指定物质的主要成分对应正确的是( )
| A. | CH4--天然气 | B. | CaO--熟石灰 | C. | Na2CO3--小苏打 | D. | NaHCO3--苏打粉 |
15.下列说法正确的是( )
| A. | 氢氧化铁胶体属于纯净物 | B. | Na2O2是碱性氧化物 | ||
| C. | BaSO4是强电解质 | D. | 纯碱属于碱类物质 |
2.下列叙述不正确的是( )
| A. | 钠和钾的合金在常温下呈液态,通常用作原子反应堆的导热剂 | |
| B. | 氢的两种同位素氘和氚可用来作氢弹 | |
| C. | 为了观察氢气燃烧时的火焰颜色,可将玻璃导管换成石英管 | |
| D. | 56度的二锅头白酒中乙醇的质量分数为56% |
19.化学概念在逻辑上存在如下关系:
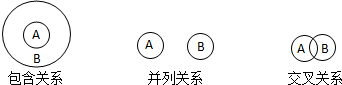
对下列概念的说法正确的是( )

对下列概念的说法正确的是( )
| A. | 纯净物与混合物属于包含关系 | |
| B. | 胶体与分散系属于交叉关系 | |
| C. | 置换反应与离子反应属于交叉关系 | |
| D. | 氧化还原反应与分解反应属于并列关系 |
1.下列有关物质性质的比较,错误的是( )
| A. | 溶解度(25℃):小苏打<苏打 | B. | 沸点:H2Se>H2S>H2O | ||
| C. | 密度:溴乙烷>水 | D. | 碳碳键键长:乙烯<苯 |