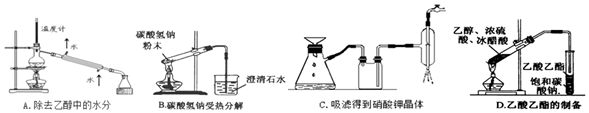
题目内容
6.下列指定反应的离子方程式正确的是( )| A. | AlCl3溶液中加入过量氨水:A13++4 NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | NaA1O2溶液中AlO2-的水解:AlO2-+2H2O═A1(OH)3↓+OH- | |
| C. | AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag++I-═AgI↓ | |
| D. | 明矾净水原理:A13++3H2O?A1(OH)3(胶体)+3H+ |
分析 A.一水合氨弱碱,不能拆开;
B.偏铝酸根离子的水解为可逆反应,应该用可逆号;
C.氯化银为难溶物不能拆开,AgI不能用沉淀符号;
D.铝离子水解生成氢氧化铝胶体,能够净水.
解答 解:A.AlCl3溶液中加入过量氨水,反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.NaA1O2溶液中AlO2-的水解程度较小,不能使用沉淀符号,正确的离子方程式为:AlO2-+2H2O?A1(OH)3+OH-,故B错误;
C.AgCl悬浊液中加入KI溶液得到黄色沉淀,正确的离子方程式为:AgCl+I-═AgI+Cl-,故C错误;
D.明矾净水原理为:A13++3H2O?A1(OH)3(胶体)+3H+,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
15.要使氯化铝溶液中的Al3+完全转化为Al(OH)3沉淀,选用的合理试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | 澄清石灰水 | D. | Mg(OH)2 |
16.某化学兴趣小组的同学利用图所示实验装置进行实验.
(1)气体发生装置中反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验室常用排饱和食盐水的方法来收集 Cl2,试用化学平衡原理加以解释因为饱和食盐水中 C(Cl-)较大,促使平衡 Cl2+H2O?H++Cl-+HClO逆向移动,减少Cl2 的溶解.
以下甲学生对 Cl2 与 FeCl2 和 KSCN 混合溶液的反应进行实验探究.
(3)A 中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(4)为了探究现象 II 的原因,甲同学进行如下实验.
①取 A 中黄色溶液于试管中,加入 NaOH 溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取 A 中黄色溶液于试管中,加入过量的 KSCN 溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是 SCN-与 Cl2发生了反应.
(5)甲同学猜想 SCN-可能被 Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为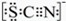
①甲同学认为 SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取 A 中黄色溶液于试管中,加入用盐酸酸化的 BaCl2溶液,产生白色沉淀,由此证明被氧化的元素是硫元素(填名称).
③通过实验证明了 SCN-中氮元素转化为 NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在SCN-中氮元素被氧化成NO3-.中被氧化的元2
④若 SCN-与 Cl反应生成 CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+16Cl-+18H+,.
| 操作 | 现象 |
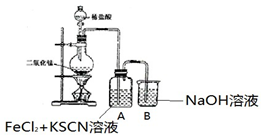 | I.A 中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)实验室常用排饱和食盐水的方法来收集 Cl2,试用化学平衡原理加以解释因为饱和食盐水中 C(Cl-)较大,促使平衡 Cl2+H2O?H++Cl-+HClO逆向移动,减少Cl2 的溶解.
以下甲学生对 Cl2 与 FeCl2 和 KSCN 混合溶液的反应进行实验探究.
(3)A 中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(4)为了探究现象 II 的原因,甲同学进行如下实验.
①取 A 中黄色溶液于试管中,加入 NaOH 溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取 A 中黄色溶液于试管中,加入过量的 KSCN 溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是 SCN-与 Cl2发生了反应.
(5)甲同学猜想 SCN-可能被 Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
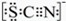
①甲同学认为 SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取 A 中黄色溶液于试管中,加入用盐酸酸化的 BaCl2溶液,产生白色沉淀,由此证明被氧化的元素是硫元素(填名称).
③通过实验证明了 SCN-中氮元素转化为 NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在SCN-中氮元素被氧化成NO3-.中被氧化的元2
④若 SCN-与 Cl反应生成 CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+16Cl-+18H+,.
1.下列关于有机化合物的说法正确的是( )
| A. | 可以用新制的氢氧化铜悬浊液(可加热)鉴别乙醇、乙酸和葡萄糖溶液 | |
| B. | 不含其他杂质的天然油脂属于纯净物 | |
| C. | 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 苯和乙烯都能使溴水褪色,但两者发生的化学反应类型不同 |
11.80℃时,NO2(g)+SO2(g)?SO3(g)+NO(g).该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| C(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| C(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 平衡时,丙中SO2的转化率大于50% | |
| B. | 当反应平衡时,乙中c(NO2)是甲中的2倍 | |
| C. | 温度升至90℃,上述反应平衡常数为$\frac{25}{26}$,则Z正反应为吸热反应 | |
| D. | 其他条件不变,若起始时向容器乙中充入0.10mol•L-lNO2和0.20mol•L-lSO2,达到平衡时c(NO)与原平衡相同 |
18.有机物B、C、D互为( )
| A. | 同位素 | B. | 同系物 | C. | 同分异构体 | D. | 同素异形体 |
16.柠檬烯是一种食用香料,其结构简式如图所示 .下列有关柠檬烯的说法正确的是( )
.下列有关柠檬烯的说法正确的是( )
 .下列有关柠檬烯的说法正确的是( )
.下列有关柠檬烯的说法正确的是( )| A. | 该物质常温下为液态,易溶于水 | |
| B. | 它的苯环上的一氯化物有4种 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它可以发生加成、取代、氧化等反应 |