题目内容
19.A、B、C、D、E五种短周期元素的原子序数依次增大,A、B同周期,A、C同主族,化学物AB2、DB2均是可使澄清石灰水变浑浊的气体.又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体.(1)写出A、B、C、D、E元素的名称:A碳,B氧,C硅,D硫,E氯.
(2)写出DB2使澄清石灰水变浑浊的化学方程式:SO2+Ca(OH)2=CaSO3↓+H2O.
(3)写出C、E单质分别与NaOH溶液反应的离子方程式:Si+2OH-+H2O=SiO32-+2H2↑;Cl2+2OH-=Cl-+ClO-+H2O.
分析 A、B、C、D、E五种短周期元素的原子序数依次增大,A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体,常见气体有CO2、SO2,则可知A为C元素,B为O元素,D为S元素;A、C同主族,C与NaOH溶液反应可产生氢气,则C为Si;E的单质可与NaOH溶液反应,E的原子序数大于硫,则E为Cl,据此解答.
解答 解:A、B、C、D、E五种短周期元素的原子序数依次增大,A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体,常见气体有CO2、SO2,则可知A为C元素,B为O元素,D为S元素;A、C同主族,C与NaOH溶液反应可产生氢气,则C为Si;E的单质可与NaOH溶液反应,E的原子序数大于硫,则E为Cl.
(1)由上述分析可知,A为碳,B为氧,C为硅,D为硫,E为氯,故答案为:碳;氧;硅;硫;氯;
(2)SO2使澄清石灰水变浑浊的化学方程式:SO2+Ca(OH)2=CaSO3↓+H2O,故答案为:SO2+Ca(OH)2=CaSO3↓+H2O;
(3)C单质与氢氧化钠溶液反应离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,E单质与NaOH溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Si+2OH-+H2O=SiO32-+2H2↑;Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查元素化合物推断,注意从使澄清石灰水变浑浊的气体入手进行推断,难度不大,侧重化学用语的考查.

练习册系列答案
相关题目
10.下列有关实验的操作、现象和结论或解释 都正确的是( )
| 选项 | 操作 | 现象 | 结论或解释 |
| A | 用pH计或pH试纸分别测定饱和SO2水溶液和饱和CO2水溶液的pH值 | 饱和SO2水溶液的pH值小于饱和CO2水溶液 | 亚硫酸强于碳酸 |
| B | 向加热KClO3制氧气后的残余固体中加入浓H2SO4,继续加热 | 产生黄绿色气体 | 浓硫酸与残渣中的KCl发生反应生成了Cl2 |
| C | 加热装在试管中的NH4Cl晶体 | 试管底部的晶体消失,试管上部有晶体凝结. | NH4Cl晶体发生了升华. |
| D | 将一根较粗的铜丝在酒精灯火焰上加热到红热,然后趁热插入乙醇中一会儿取出. | 铜丝先变黑后又变红,乙醇中伴有刺激性气味产生. | 铜丝发生了几个反应,但铜丝前后的质量不变. |
| A. | A | B. | B | C. | C | D. | D |
14. 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
(1)氮气性质稳定,可用作保护气.请用电子式表示氮气的形成过程:
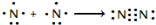 .
.
(2)联氨(N2H4)是一种还原剂.已知:H2O(l)=H2O(g)△H=+44kJ/mol.试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol.
(3)KCN可用于溶解难溶金属卤化物.将AgI溶于KCN溶液中,形成稳定的Ag(CN)2-,该转化的离子方程式为:AgI(s)+2CN-(aq)?Ag(CN)2-(aq)+I-(aq).若已知Ksp(AgI)=1.5×10-16,K稳[Ag(CN)2-]=1.0×1021,则上述转化方程式的平衡常数K=1.5×10-37.(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸.该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:NH3-5e-+5OH-=NO+4H2O.
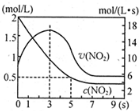
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2?N2O4其相关图象如下.
①0~3s时v(NO2)增大的原因是容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大.
②5s时NO2转化率为75%.
 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:(1)氮气性质稳定,可用作保护气.请用电子式表示氮气的形成过程:
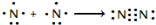 .
.(2)联氨(N2H4)是一种还原剂.已知:H2O(l)=H2O(g)△H=+44kJ/mol.试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol.
| 化学键 | N-H | N-N | N=N | N≡N | O=O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(4)氨的催化氧化用于工业生产硝酸.该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:NH3-5e-+5OH-=NO+4H2O.
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2?N2O4其相关图象如下.
①0~3s时v(NO2)增大的原因是容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大.
②5s时NO2转化率为75%.
4.下列说法正确的是( )
| A. | 相同条件下,测得Na2CO3溶液的pH大于相同物质的量浓度的Na2SO3溶液,说明非金属性:C<S | |
| B. | 绝热容器中,向50 mL 1 mol•L-1的盐酸中加入烧碱,水的KW不变 | |
| C. | 相同温度时,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 | |
| D. | 有HX和HY两种弱酸且酸性HX>HY,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有 c(X-)>c(Y-)>c(OH-)>c(H+) |
8.纳米CdSe(硒化镉)可用作光学材料.在一定条件下,由Na2SO3和Se反应生成Na2SeSO3(硒代硫酸钠);再由CdCl2形成的配合物与Na2SeSO3反应制得CdSe纳米颗粒.流程图如下:
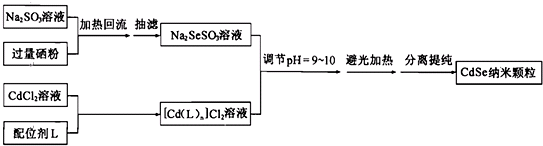
已知:①纳米颗粒通常指平均粒径为1~100nm的粒子
②CdSe纳米颗粒的大小影响会其发光性质.在一定配位剂浓度下,避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,结果如图1所示;某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图2所示:

则下列说法中正确的是( )

已知:①纳米颗粒通常指平均粒径为1~100nm的粒子
②CdSe纳米颗粒的大小影响会其发光性质.在一定配位剂浓度下,避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,结果如图1所示;某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图2所示:

则下列说法中正确的是( )
| A. | 在分离提纯CdSe时一般向溶液中加入丙酮,以增强溶剂极性,有利于CeSe的沉淀,提高收率 | |
| B. | 一般可用NaOH调节Na2SeSO3溶液的pH值,在此过程中会有HSe-和HSO3-生成 | |
| C. | 该纳米颗粒不能使用常压过滤或者减压过滤分离,因为其易在滤纸表面形成一层致密而厚实的膜,阻碍溶剂的通过 | |
| D. | 改变反应温度和反应时间,可以得到不同发光性质的CdSe纳米颗粒;且若要在60℃得到3.0 nm的CdSe纳米颗粒,可尝试降低配位剂浓度的方法 |
2.下列粒子半径大小的比较正确的是( )
| A. | Na+<Mg2+<Al3+<O2- | B. | S2->Cl->Na+>Al3+ | ||
| C. | Na<Mg<Al<S | D. | Cs<Rb<K<Na |
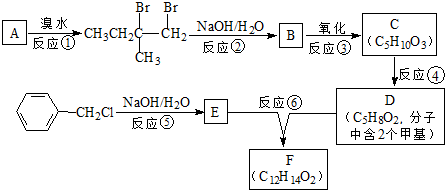
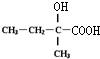
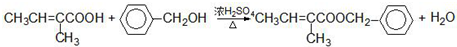 .
. :
: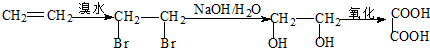 .
.
 $\stackrel{NaNO_{2}}{→}$
$\stackrel{NaNO_{2}}{→}$


 .
. .D→E的反应类型是氧化反应.
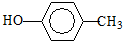
.D→E的反应类型是氧化反应. )也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有3种,写出一种X可能的结构简式
)也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有3种,写出一种X可能的结构简式 (邻、间、对位置均可).
(邻、间、对位置均可).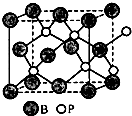 X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.
X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.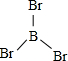 .
. .
.