题目内容
13.若98%的硫酸可表示为SO3•$\frac{10}{9}$H2O,20%的发烟硫酸可表示为SO3•aH2O,则a的值为$\frac{209}{160}$(用分数表示).分析 20%发烟硫酸可表示为H2O•aSO3,通过整理即为:H2SO4•(a-1)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98:80(a-1)=(1-20%):20%,解出a即可
解答 解:20%发烟硫酸可表示为H2O•aSO3,通过整理即为:H2SO4•(a-1)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98:80(a-1)=(1-20%):20%,
解得:b=$\frac{209}{160}$,
故答案为:$\frac{209}{160}$.
点评 本题考查了溶质质量分数的计算,题目难度中等,正确分析题干信息为解答关键,注意掌握溶质质量分数的概念及表达式,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 46g NO2和N2O4以任意比混合,所得混合气体中氧原子数2NA | |
| B. | 标准状况下,含NA个共价键的HF分子所占的体积约为22.4 L | |
| C. | 1mol Fe 与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA | |
| D. | 2mol NO和1mol O2混合,在密闭容器中充分反应后,容器内的分子数小于2NA |
4.今有两种正盐的稀溶液,分别是a mol/L NaX溶液和b mol/L NaY溶液,下列说法中不正确的是( )
| A. | 若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY | |
| B. | 若a=b,并测得溶液中c(X-)=c(Y-)+c(HY)(c(HY)≠0),则相同浓度时,酸性HX>HY | |
| C. | 若a>b,并测得溶液中c(HX)=c(HY),则可推出溶液中c(X-)>c(Y-),且相同浓度时,酸性HX>HY | |
| D. | 若两溶液等体积混合,测得溶液中c(X-)+c(Y-)+c(HX)+c(HY)=0.1 mol/L,则可推出a+b=0.2 mol/L |
1.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 常见气态氢化物的稳定性:X<Y<Z | |
| C. | 1molWM溶于足量水中完全反应,共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
8.当冰醋酸固体变成液体或气体时,一定发生变化的是( )
| A. | 分子内化学键 | B. | 共价键键能 | C. | 分子的构型 | D. | 分子间作用力 |
18.X、Y、Z、T是四种原子序数递增的短周期元素,X形成的简单阳离子核外无电子,Y的最高价氧化物对应的水化物是强酸,Z是人体内含量最多的元素,T在同周期元素形成的简单阳离子中半径最小,则以下说法正确的是( )
| A. | 元素最高化合价的顺序为Z>Y>T>X | |
| B. | Y、Z分别形成的简单氢化物的稳定性为Z>Y | |
| C. | 由X、Y和Z三种元素构成的强电解质,对水的电离均起抑制作用 | |
| D. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液不能反应 |
5.摩尔盐在工业上有重要的用途.已知其由一种阴离子,两种阳离子组成的晶体,某学习小组按如下实验测定摩尔盐样品的组成.步骤如下:
①称取3.920g摩尔盐样品配制250mL溶液.
②取少量配制溶液,加入KSCN溶液,无明显现象.
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀.
④定量测定如下:
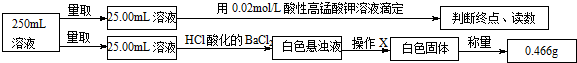
滴定实验结果记录如下:
完成下列填空:
(1)步骤①中需要的定量仪器为电子天平、250mL容量瓶.
(2)步骤②的目的是确定红褐色沉淀中的铁元素在摩尔盐中是以亚铁离子形式存在.产生红褐色沉淀的离子方程式4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓.
(3)步骤④中操作X为过滤、洗涤、干燥或烘干(冷却)(按操作顺序填写).
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,不能(填“能”或“不能”),请说明理由碘单质与亚铁离子不反应.
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将偏小.(选填“偏大”、“偏小”或“不变”).
(6)通过上述实验测定结果,推断摩尔盐化学式为(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O.
①称取3.920g摩尔盐样品配制250mL溶液.
②取少量配制溶液,加入KSCN溶液,无明显现象.
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀.
④定量测定如下:

滴定实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
(1)步骤①中需要的定量仪器为电子天平、250mL容量瓶.
(2)步骤②的目的是确定红褐色沉淀中的铁元素在摩尔盐中是以亚铁离子形式存在.产生红褐色沉淀的离子方程式4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓.
(3)步骤④中操作X为过滤、洗涤、干燥或烘干(冷却)(按操作顺序填写).
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,不能(填“能”或“不能”),请说明理由碘单质与亚铁离子不反应.
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将偏小.(选填“偏大”、“偏小”或“不变”).
(6)通过上述实验测定结果,推断摩尔盐化学式为(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O.
2.下列物质中,即含有离子键,又含有共价键的是( )
| A. | H2SO4 | B. | NaOH | C. | Na2O | D. | H2O2 |
3.下列实验操作正确的是( )


| A. | 稀释浓硫酸时把水沿着烧杯内壁缓慢注入浓硫酸中,并用玻璃棒搅拌 | |
| B. | 称量2.0gNaOH固体时先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 | |
| C. | 用装置甲除去乙烯中少量SO2气体 | |
| D. | 用装置乙分液,从分液漏斗下口放出有机相,关闭活塞再从分液漏斗上口倒出水相 |