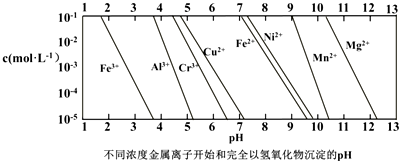
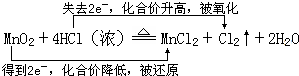
题目内容
5.下列不能与浓H2SO4反应的物质是( )| A. | Cu | B. | C | C. | Na2CO3 | D. | SiO2 |
分析 A、铜与浓硫酸在加热的条件下生成硫酸铜和二氧化硫;
B、碳与浓硫酸反应生成二氧化碳和二氧化硫;
C、碳酸钠与硫酸反应生成硫酸钠和二氧化碳气体;
D、二氧化硅是酸性氧化物与浓硫酸不反应.
解答 解:A、铜与浓硫酸在加热的条件下生成硫酸铜和二氧化硫,能反应,不符合条件,故A不选;
B、碳与浓硫酸反应生成二氧化碳和二氧化硫,能反应,不符合条件,故B不选;
C、碳酸钠与硫酸反应生成硫酸钠和二氧化碳气体,能反应,不符合条件,故C不选;
D、二氧化硅是酸性氧化物与浓硫酸不反应,不能反应,符合条件,故D选;
故选D.
点评 本题考查浓硫酸的化学性质,浓硫酸具有极强的氧化性,能与大多数金属和非金属反应的强酸,比较容易.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
16.某学生欲通过实验验证Fe2+的性质.
(1)该同学在实验前,依据Fe的还原性,填写了下表.
依照表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.为探究溶液变为深棕色的原因,该同学进行了如下实验.
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)查阅资料,发现溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
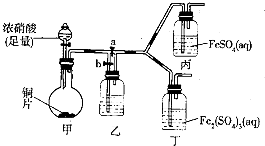
Ⅰ、打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
Ⅱ、打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ、为与I中实验对照,更换丙、丁后,使甲中反应继续,观察到的现象与步骤I中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤II的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,他的实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
(1)该同学在实验前,依据Fe的还原性,填写了下表.
| 实验操作 | 预期现象 | 离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)查阅资料,发现溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.

Ⅰ、打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
Ⅱ、打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ、为与I中实验对照,更换丙、丁后,使甲中反应继续,观察到的现象与步骤I中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤II的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,他的实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
13.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 高温或日常用的消毒剂可使禽流感病毒蛋白质变性 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
10.在含有较多NH4+、Ba2+、Cl-的溶液中还能大量共存的离子是( )
| A. | SO42- | B. | OH- | C. | Ag+ | D. | Mg2+ |
17.对下列物质用途的描述不符合事实的是( )
| A. | 硅酸钠可用作木材防火涂料 | B. | Fe2O3可用作外墙涂料 | ||
| C. | 过氧化钠可用作潜艇供氧剂 | D. | 铝制容器可以贮运稀硝酸 |
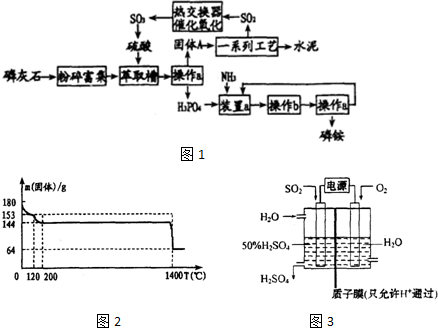
 .
.