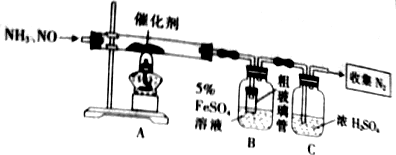
题目内容
9.在N2 (g)+3H2(g)?2NH3 (g)的平衡体系中,其他条件不变,增加氮气的浓度,下列判断正确的是( )| A. | 氮气的转化率减小 | |
| B. | 氢气的转化率增大 | |
| C. | 氨气在平衡混合气体中的百分含量一定增大 | |
| D. | 氨气的分解速率大于氨气的生成速率 |
分析 其他条件不变,增加氮气的浓度,反应物浓度增大,则化学平衡正向移动,以此来解答.
解答 解:A.增大氮气的浓度,平衡正向移动,但氮气的总浓度增大,氮气的转化率减小,故A正确;
B.增大氮气的浓度,平衡正向移动,氢气的转化率增大,故B正确;
C.氨气的物质的量增大,但混合气体的总物质的量增大的多,则氨气在平衡混合气体中的百分含量可能减小,故C错误;
D.平衡正向移动,氨气的生成速率大于氨气的分解速率,故D错误;
故选AB.
点评 本题考查化学平衡的移动,为高频考点,把握反应物浓度增大平衡正向移动为解答的关键,侧重分析与应用能力的考查,注意转化率及含量的判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是( )


| A. | 该反应的热化学方程式为:N2(g)+O2(g)=2NO(g)△H=+180 kJ•mol-1 | |
| B. | 1 mol N2(l)和NA个 O2(l)反应生成2mol NO(g)时,吸收的能量为180 kJ | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
11.足量铁粉与一定量的盐酸反应,能产生一定量的氢气.为减慢反应速率,但不影响H2的总量,可以加入下列物质中的( )
| A. | CuSO4 | B. | NaOH | C. | Na2CO3 | D. | CH3COONa |
4.粗盐中含有可溶性杂质CaCl2、MgCl2和Na2SO4,若要得到纯净的NaCl固体,有如下实验操作:
①蒸发结晶
②加入过量NaOH溶液
③加入过量BaCl2溶液
④加入过量Na2CO3溶液
⑤加入过量盐酸
⑥过滤.
正确的实验操作顺序是( )
①蒸发结晶
②加入过量NaOH溶液
③加入过量BaCl2溶液
④加入过量Na2CO3溶液
⑤加入过量盐酸
⑥过滤.
正确的实验操作顺序是( )
| A. | ②③④⑤⑥① | B. | ③④②⑤① | C. | ③②④⑥⑤① | D. | ④③⑥⑤① |
14.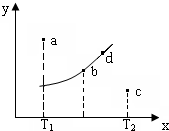 图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )
图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )
 图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )
图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )| A. | Q<0 | |
| B. | 平衡常数值:b点<d点 | |
| C. | T1温度下若由a点达到平衡,可以采取增大压强的方法 | |
| D. | c点v(正)<v(逆) |
1.下列说法正确的是( )
| A. | 碱金属单质的熔点随原子序数的增大而降低 | |
| B. | 金属元素的最外层电子数都小于4 | |
| C. | 已知硒(Se)位于第四周期第ⅥA族,其最高价氧化物对应水化物的化学式为H2SeO3 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
19.下表中对应关系正确的是( )
| A | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由蛋白质得到氨基酸、由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br-═2Cl-+Br2 Zn+Cu2+═Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O═4NaOH+O2↑ Cl2+H2O═HCl+HClO | 均为水作还原剂的氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |