题目内容
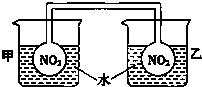 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.①按图所示将实验装置连接好.
②向甲烧杯的水中投入一定量的CaO固体,此烧杯中的NO2平衡混合气体的红棕色变深;向乙烧杯中加入NH4NO3晶体,此时烧杯中NO2平衡混合气体颜色变浅.
回答下列问题:
(1)CaO与水反应的化学方程式为
(2)NH4NO3晶体溶于水温度
(3)查阅资料知NO2的平衡气体中存在的可逆反应为2NO2(g)?N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,平衡
考点:反应热和焓变,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)CaO与水反应生成氢氧化钙,该反应是放热反应;
(2)硝酸铵溶解于水后吸热,所以会使溶液温度明显降低,是物理变化所以不是吸热反应;
(3)2NO2(g)?N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都加快,混合气体的颜色不变说明二氧化氮的浓度不变,化学反应达平衡状态.
(2)硝酸铵溶解于水后吸热,所以会使溶液温度明显降低,是物理变化所以不是吸热反应;
(3)2NO2(g)?N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都加快,混合气体的颜色不变说明二氧化氮的浓度不变,化学反应达平衡状态.
解答:
解:(1)CaO与水反应生成氢氧化钙,反应方程式为CaO+H2O═Ca(OH)2,该反应为放热反应,故答案为:CaO+H2O═Ca(OH)2;放热反应;
(2)硝酸铵溶解于水后吸热,所以会使溶液温度明显降低,溶解过程是物理变化所以不是吸热反应,故答案为;降低;不是;
(3)2NO2(g)?N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都加快,混合气体的颜色不变说明二氧化氮的浓度不变,化学反应达平衡状态,故答案为:发生移动;增大;能.
(2)硝酸铵溶解于水后吸热,所以会使溶液温度明显降低,溶解过程是物理变化所以不是吸热反应,故答案为;降低;不是;
(3)2NO2(g)?N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都加快,混合气体的颜色不变说明二氧化氮的浓度不变,化学反应达平衡状态,故答案为:发生移动;增大;能.
点评:本题考查了化学反应速率、平衡移动,反应的热效应和化学方程式书写,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
用四氯化碳萃取溴水中的溴,下列说法中不正确的是( )
| A、实验中使用的主要仪器是分液漏斗 |
| B、溴在四氯化碳中的溶解度比在水中的溶解度大 |
| C、不可把萃取剂四氯化碳换成酒精 |
| D、分液时,水及溴的四氯化碳溶液均从分液漏斗下口流出 |
为证明某可溶性一元酸(HX)是弱酸,有如下实验方案,其中不合理的是( )
| A、室温下,测0.1mol/L HX溶液的pH,若pH>1,证明HX是弱酸 |
| B、室温下,测1mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 |
| C、将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 |
| D、相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |
在pH等于1的盐酸和硫酸溶液中,物质的量相等的是( )
| A、盐酸和硫酸 |
| B、H+ |
| C、Cl-与SO42- |
| D、H+与SO42- |
下列各组混合物,可以用分液漏斗分离的是( )
| A、四氯化碳与溴的混合物 |
| B、植物油和水 |
| C、双氧水和水的混合物 |
| D、酒精和水的混合物 |
根据“相似相溶”规律,你认为下列物质在水中溶解度较大的是( )
| A、乙烯 | B、二氧化碳 |
| C、二氧化硫 | D、氢气 |
 (1)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数填写在方框里:
(1)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数填写在方框里: