题目内容
已知H2S 有可燃烧性,燃烧时氧气的量不同,产物也不同.
(1)在标准状况下,H2S和O2 的混合气体120mL,经点燃后,反应至完全,所得气体经干燥后,恢复到原来状况,体积为15mL,该15mL气体可能是
A.H2S和SO2 B.O2 C.H2S D.SO2和O2
(2)若标准状况下,上述气体,H2S和O2 的混合气体120mL,经点燃后,反应至完全,所得气体经干燥后,恢复到原来状况,体积为30mL,求原气体可能的组成.
(3)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时点燃会发生爆炸,当硫化氢在空气中的体积分数为20%时,其爆炸产物是 .
(4)在标准状况下,将120mL H2S和O2的混合气体点燃,若原混合气体中H2S 为x mL,反应后所得气体的总体积为y mL,求:
①当x在不同范围时y与x的函数关系.
②当y=60mL时,原H2S 的体积可能是多少.
(1)在标准状况下,H2S和O2 的混合气体120mL,经点燃后,反应至完全,所得气体经干燥后,恢复到原来状况,体积为15mL,该15mL气体可能是
A.H2S和SO2 B.O2 C.H2S D.SO2和O2
(2)若标准状况下,上述气体,H2S和O2 的混合气体120mL,经点燃后,反应至完全,所得气体经干燥后,恢复到原来状况,体积为30mL,求原气体可能的组成.
(3)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时点燃会发生爆炸,当硫化氢在空气中的体积分数为20%时,其爆炸产物是
(4)在标准状况下,将120mL H2S和O2的混合气体点燃,若原混合气体中H2S 为x mL,反应后所得气体的总体积为y mL,求:
①当x在不同范围时y与x的函数关系.
②当y=60mL时,原H2S 的体积可能是多少.
考点:硫化氢,化学方程式的有关计算
专题:计算题,氧族元素
分析:(1)(2)H2S和O2的混合气体点燃后充分反应,如氧气足量发生2H2S+3O2
2SO2+2H2O,剩余气体可能为SO2或二者都有;如氧气不足,发生2H2S+O2
2S+2H2O,剩余气体H2S,以此解答该题;
(3)硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸,当硫化氢气体在空气中的体积分数为20%时计算混合气体硫化氢和氧气的体积分数,依据硫化氢和氧气反应的定量关系分析判断产物,2H2S+3O2=2SO2+2H2O;2H2S+O2=2S+2H2O;
(4)剩余体积为60ml,由于剩余气体较多,剩余的气体为O2和SO2,氧气过量,发生2H2S+3O2
2SO2+2H2O,根据方程式计算.
| ||
| ||
(3)硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸,当硫化氢气体在空气中的体积分数为20%时计算混合气体硫化氢和氧气的体积分数,依据硫化氢和氧气反应的定量关系分析判断产物,2H2S+3O2=2SO2+2H2O;2H2S+O2=2S+2H2O;
(4)剩余体积为60ml,由于剩余气体较多,剩余的气体为O2和SO2,氧气过量,发生2H2S+3O2
| ||
解答:
解:(1)①如氧气足量,则发生2H2S+3O2
2SO2+2H2O,
如剩余气体为O2和SO2或SO2,则H2S和O2共反应120mL-15mL=105mL,则反应的H2S体积为105mL×
=42mL,
则生成SO2的体积为42mL>15mL,不符合题意;
②若生成产物为SO2和S,则SO2为15ml,
则先后发生 2H2S+O2
2S+2H2O
×105ml
×105ml
S+O2
SO2,
15ml 15ml
即H2S为70mL,O2为50mL,二者体积之和为120ml,符合题意;
③如剩余气体为H2S,则发生2H2S+O2
2S+2H2O,
H2S和O2共反应120mL-15mL=105mL,
则H2S为105mL×
+15mL=85mL,O2为105mL×
mL=35mL,二者体积之和为120ml,符合题意;
故答案为:C;
(2)①如氧气足量,则发生2H2S+3O2
2SO2+2H2O,
如剩余气体为O2和SO2或SO2,则H2S和O2共反应120mL-30mL=90mL,则反应的H2S体积为90mL×
=36mL,
则生成SO2的体积为36mL>30mL,不符合题意;
②若生成产物为SO2和S,则SO2为30ml,
则先后发生 2H2S+O2
2S+2H2O
×90ml
×90ml
S+O2
SO2,
30ml 30ml
即H2S为60mL,O2为60mL,二者体积之和为120ml,符合题意;
③如剩余气体为H2S,则发生2H2S+O2
2S+2H2O,
H2S和O2共反应120mL-30mL=90mL,
则H2S为90mL×
+30mL=90mL,O2为90mL×
mL=30mL,二者体积之和为120ml,符合题意;
答:原气体可能的组成为:H2S为60mL,O2为60mL或H2S为90mL,O2为30mL;
(3)当硫化氢在空气中的体积分数为20%时,O2在混合气体中的体积分数为80%×
=16%,O2不足,发生反应2H2S+O2
2S↓+2H2O;
故答案为:S、H2O;
(4)①如氧气足量,则发生2H2S+3O2
2SO2+2H2O,
则硫化氢:x≤120×
=48ml,则生成的SO2 为xml,消耗的氧气
xml,则120-(x+
x)+x=y,
所以x≤48时,120-
x=y;
当60>x>48,则生成产物为SO2和S,则SO2为yml,
则先后发生 2H2S+O2
2S+2H2O
×(120-y)
×(120-y)
S+O2
SO2,
yml yml
则H2S为
×(120-y)=x,氧气为
×(120-y)+y;
所以当60>x>48时,240-2x=3y;
当x>60,则剩余气体为H2S为yml,则发生2H2S+O2
2S+2H2O,
H2S和O2共反应120mL-ymL,
则H2S为(120-y)mL×
+ymL=xmL,即360+y=3x;
答:当x在不同范围时y与x的函数关系为:x<48时,120-
x=y;当60>x>48时,240-2x=3y;当x>60时,240+y=3x;
②当y=60mL时,剩余的气体为O2和SO2,氧气过量,发生2H2S+3O2
2SO2+2H2O
设硫化氢为xml,生成的二氧化硫为xml,则120-(x+
x)+x=60,
解得x=40,
答:原H2S 的体积可能是40ml.
| ||
如剩余气体为O2和SO2或SO2,则H2S和O2共反应120mL-15mL=105mL,则反应的H2S体积为105mL×
| 2 |
| 5 |
则生成SO2的体积为42mL>15mL,不符合题意;
②若生成产物为SO2和S,则SO2为15ml,
则先后发生 2H2S+O2
| ||
| 2 |
| 3 |
| 1 |
| 3 |
S+O2
| ||
15ml 15ml
即H2S为70mL,O2为50mL,二者体积之和为120ml,符合题意;
③如剩余气体为H2S,则发生2H2S+O2
| ||
H2S和O2共反应120mL-15mL=105mL,
则H2S为105mL×
| 2 |
| 3 |
| 1 |
| 3 |
故答案为:C;
(2)①如氧气足量,则发生2H2S+3O2
| ||
如剩余气体为O2和SO2或SO2,则H2S和O2共反应120mL-30mL=90mL,则反应的H2S体积为90mL×
| 2 |
| 5 |
则生成SO2的体积为36mL>30mL,不符合题意;
②若生成产物为SO2和S,则SO2为30ml,
则先后发生 2H2S+O2
| ||
| 2 |
| 3 |
| 1 |
| 3 |
S+O2
| ||
30ml 30ml
即H2S为60mL,O2为60mL,二者体积之和为120ml,符合题意;
③如剩余气体为H2S,则发生2H2S+O2
| ||
H2S和O2共反应120mL-30mL=90mL,
则H2S为90mL×
| 2 |
| 3 |
| 1 |
| 3 |
答:原气体可能的组成为:H2S为60mL,O2为60mL或H2S为90mL,O2为30mL;
(3)当硫化氢在空气中的体积分数为20%时,O2在混合气体中的体积分数为80%×
| 1 |
| 5 |
| ||
故答案为:S、H2O;
(4)①如氧气足量,则发生2H2S+3O2
| ||
则硫化氢:x≤120×
| 2 |
| 5 |
| 3 |
| 2 |
| 3 |
| 2 |
所以x≤48时,120-
| 3 |
| 2 |
当60>x>48,则生成产物为SO2和S,则SO2为yml,
则先后发生 2H2S+O2
| ||
| 2 |
| 3 |
| 1 |
| 3 |
S+O2
| ||
yml yml
则H2S为
| 2 |
| 3 |
| 1 |
| 3 |
所以当60>x>48时,240-2x=3y;
当x>60,则剩余气体为H2S为yml,则发生2H2S+O2
| ||
H2S和O2共反应120mL-ymL,
则H2S为(120-y)mL×
| 2 |
| 3 |
答:当x在不同范围时y与x的函数关系为:x<48时,120-
| 3 |
| 2 |
②当y=60mL时,剩余的气体为O2和SO2,氧气过量,发生2H2S+3O2
| ||
设硫化氢为xml,生成的二氧化硫为xml,则120-(x+
| 3 |
| 2 |
解得x=40,
答:原H2S 的体积可能是40ml.
点评:本题考查混合物计算、过量计算、讨论计算等,难度较大,清楚反应过程是解题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,加入少量下列固体物质,能使平衡逆向移动的是( )
| A、NaCl |
| B、Na2C03 |
| C、NaOH |
| D、CH3COONa |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、乙烷与Cl2在光照下反应,每有NA个氢原子被氯替代,需消耗标准状况下Cl2 11.2L |
| B、1mol苯中含有3NA个碳碳双键 |
| C、14g乙烯和丙烯的混合物中含有3NA对共用电子对 |
| D、标准状况下,22.4L己烷中的碳原子数为6NA |
电解质有强弱之分,属于弱电解质的物质是( )
| A、氢氧化钠溶液 | B、水 |
| C、氯化钠固体 | D、硫酸钡 |
关于胶体和溶液的区别,下列叙述中正确的是( )
| A、溶液中溶质微粒作有规律的运动,胶体粒子运动无规律 |
| B、溶液中溶质微粒一定不带电,胶体中分散质微粒带电荷 |
| C、溶液中通过一束光,无特殊现象,而胶体中有“光亮的通路” |
| D、溶液呈电中性,胶体带有电荷 |
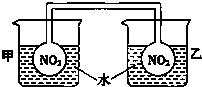 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.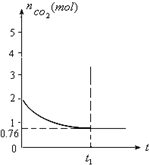 一定温度下2升的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:
一定温度下2升的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应: