题目内容
根据“相似相溶”规律,你认为下列物质在水中溶解度较大的是( )
| A、乙烯 | B、二氧化碳 |
| C、二氧化硫 | D、氢气 |
考点:相似相溶原理及其应用
专题:化学键与晶体结构
分析:相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,据此分析;
解答:
解:乙烯、二氧化碳和氢气都是非极性分子,二氧化硫属于极性分子易溶于极性分子组成的溶剂,水属于极性溶剂,所以极性分子二氧化硫在水中的溶解度较大,故C正确;
故选:C.
故选:C.
点评:本题考查了相似相溶原理,难度不大,注意相似相溶原理的使用范围.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C物质的量变化如图(Ⅰ)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C物质的量变化如图(Ⅰ)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )| A、在(t1+1)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| B、在(t1+1)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、不再增减物质,只改变压强或温度时,A的体积分数V(A)%变化范围为25%<V(A)%<40% |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
关于胶体和溶液的区别,下列叙述中正确的是( )
| A、溶液中溶质微粒作有规律的运动,胶体粒子运动无规律 |
| B、溶液中溶质微粒一定不带电,胶体中分散质微粒带电荷 |
| C、溶液中通过一束光,无特殊现象,而胶体中有“光亮的通路” |
| D、溶液呈电中性,胶体带有电荷 |
N2+3H2?2NH3反应达到平衡时,下列说法正确的是( )
| A、反应达到平衡时,N2将完全反应 |
| B、反应达到平衡时,正逆反应速率都为零 |
| C、平衡建立前体系总质量在不断变化而平衡建立后体系的总质量就不再变了 |
| D、N2、H2、NH3的浓度保持不变 |
下列说法中正确的是( )
| A、Na的摩尔质量为23g |
| B、Na的摩尔质量为23 |
| C、Na的摩尔质量为23g?mol-1 |
| D、Na的摩尔质量为23g?mol |
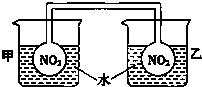 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持、加热和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持、加热和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )