题目内容
已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体(Cl2),而溶液的紫红色褪去.现有一个氧化还原反应的体系中,共有HCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,发生还原反应的过程是(填化学式) → .
(2)上述反应中,1mol氧化剂在反应中 (填“得到”或“失去”) mol电子.
(3)写出该反应的离子方程式并配平
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,已知紫红色溶液中Bi元素主要以+3价的简单阳离子存在.请写出反应的离子方程式 .
(1)该反应中,发生还原反应的过程是(填化学式)
(2)上述反应中,1mol氧化剂在反应中
(3)写出该反应的离子方程式并配平
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,已知紫红色溶液中Bi元素主要以+3价的简单阳离子存在.请写出反应的离子方程式
考点:氧化还原反应,氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)由浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,氧化反应为HCl→Cl2;
(2)KMnO4为反应的氧化剂,Mn元素化合价由+7价降低到+2价;
(3)反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4,反应物为KCl、H2SO4、KMnO4,且还原剂为HCl,氧化剂为KMnO4,结合守恒定律书写离子方程式;
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为高锰酸根离子.
(2)KMnO4为反应的氧化剂,Mn元素化合价由+7价降低到+2价;
(3)反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4,反应物为KCl、H2SO4、KMnO4,且还原剂为HCl,氧化剂为KMnO4,结合守恒定律书写离子方程式;
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为高锰酸根离子.
解答:
解:(1)由浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,说明高锰酸钾具有氧化性,还原反应为KMnO4→MnSO4,
故答案为:KMnO4;MnSO4;
(2)该反应中的氧化剂为KMnO4,Mn元素的化合价由+7价降低为+2价,则1mol氧化剂在反应中得到1mol×(7-2)=5mol电子,故答案为:得到;5;
(3)KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4中反应物为KCl、H2SO4、KMnO4,由电子守恒及质量守恒定律可知反应为2KMnO4+10KCl+8H2SO4═6K2SO4+2MnSO4+5Cl2↑+8H2O,则反应的离子方程式为2MnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O;
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为高锰酸根离子,该反应的离子方程式为:2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O,
故答案为:2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O.
故答案为:KMnO4;MnSO4;
(2)该反应中的氧化剂为KMnO4,Mn元素的化合价由+7价降低为+2价,则1mol氧化剂在反应中得到1mol×(7-2)=5mol电子,故答案为:得到;5;
(3)KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4中反应物为KCl、H2SO4、KMnO4,由电子守恒及质量守恒定律可知反应为2KMnO4+10KCl+8H2SO4═6K2SO4+2MnSO4+5Cl2↑+8H2O,则反应的离子方程式为2MnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O;
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为高锰酸根离子,该反应的离子方程式为:2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O,
故答案为:2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O.
点评:本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,着重于考查学生利用物质中元素的化合价变化来分析物质的性质并书写反应方程式,明确元素化合价是解本题关键,难度不大.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
将等体积的0.2mol?L-1 CH3COONa溶液与0.1mol?L-1 HNO3混合,混合溶液中离子浓度由大到小顺序正确的是( )
| A、c(Na+)>c(CH3COO-)>c(NO3-)>c(OH-)>c(H+) |
| B、c(Na+)>c(CH3COO-)>c(NO3-)>c(H+)>c(OH-) |
| C、c(Na+)>c(CH3COO-)>c(OH-)>c(NO3-)>c(H+) |
| D、c(CH3COO-)>c(Na+)>c(H+)>c(NO3-)>c(OH-) |
下列表示对应化学反应的离子方程式不正确的是( )
| A、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| B、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
| D、二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-═SO42-+Cl-+H2O |
水的电离平衡曲线如图所示,下列说法正确的是( )
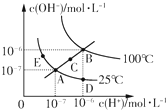

| A、图中五点KW间的关系:B>C>A=D=E |
| B、若从D点到A点,可采用在水中加入少量酸的方法 |
| C、若从A点到C点,可采用温度不变时在水中加入适量NaOH固体的方法 |
| D、若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性 |

 (1)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为
(1)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-.
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-.