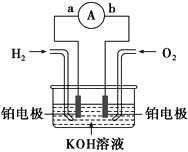
题目内容
【题目】2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为___。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表的___区。
(3)实验室常用KSCN溶液、苯酚(![]() )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
(4)铁元素能于CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为___。
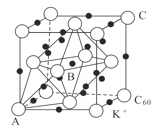
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为___,晶胞参数为428pm,则晶体密度为___g/cm3(NA表示阿伏加德罗常数的值,列出表达式)。
【答案】3d64s2 s、ds N>O>S sp2杂化 10 CN- 正四面体 正八面体 ![]() 8:3
8:3 ![]()
【解析】
![]() 原子核外电子排布式为
原子核外电子排布式为![]() ,处于过渡元素,除最外层外价电子还包含3d电子;
,处于过渡元素,除最外层外价电子还包含3d电子;![]() 为24号元素,位于元素周期表中第四周期第ⅥB族,基态原子电子排布式为
为24号元素,位于元素周期表中第四周期第ⅥB族,基态原子电子排布式为![]() ,最外层电子数为1个;
,最外层电子数为1个;![]() 同周期随原子序数增大元素第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于同一同周期相邻元素,同主族自上而下第一电离能减小;苯酚为平面结构,C原子采取
同周期随原子序数增大元素第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于同一同周期相邻元素,同主族自上而下第一电离能减小;苯酚为平面结构,C原子采取![]() 杂化;
杂化;![]() 与CO形成5个配位键,属于
与CO形成5个配位键,属于![]() 键,CO分子中有1个
键,CO分子中有1个![]() 键,
键,![]() 分子含有10个
分子含有10个![]() 键;与CO互为等电子体的离子,含有2个原子、价电子总数为10,可以用N原子与1个单位负电荷替换O原子,也可以用C原子与2个单位负电荷替换O原子;
键;与CO互为等电子体的离子,含有2个原子、价电子总数为10,可以用N原子与1个单位负电荷替换O原子,也可以用C原子与2个单位负电荷替换O原子;![]() 据图知,
据图知,![]() 占据的是
占据的是![]() 围成的正四面体空隙和正八面体空隙,若
围成的正四面体空隙和正八面体空隙,若![]() 分子的原子坐标参数分别为
分子的原子坐标参数分别为![]() 0,
0,![]() ,
,![]() 0,
0,![]() ,
,![]() 1,
1,![]() 等,说明该晶胞的参数是1,则距离A位置
等,说明该晶胞的参数是1,则距离A位置![]() 分子最近的
分子最近的![]() 为形成的正四面体体心上的;
为形成的正四面体体心上的;![]() 根据
根据![]() 中化合价代数和为零可求得晶体中
中化合价代数和为零可求得晶体中![]() 与
与![]() 的最简整数比,
的最简整数比,![]() 晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“
晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“![]() ”,再根据
”,再根据![]() 计算。
计算。
![]() 原子核外电子排布式为
原子核外电子排布式为![]() ,处于过渡元素,除最外层外价电子还包含3d电子,故价电子排布式为
,处于过渡元素,除最外层外价电子还包含3d电子,故价电子排布式为![]() ,故答案为:
,故答案为:![]() ;
;![]() 位于第四周期,基态原子电子排布式为
位于第四周期,基态原子电子排布式为![]() ,最外层电子数为1个,与Cr同周期且基态原子最外层电子数相同的元素为K和Cu,分别为s区和ds区,故答案为:s、ds;
,最外层电子数为1个,与Cr同周期且基态原子最外层电子数相同的元素为K和Cu,分别为s区和ds区,故答案为:s、ds;![]() 同周期随原子序数增大元素第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于同一同周期相邻元素的O,同主族自上而下第一电离能减小,故第一电离能
同周期随原子序数增大元素第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于同一同周期相邻元素的O,同主族自上而下第一电离能减小,故第一电离能![]() ,苯酚为平面结构,C原子采取
,苯酚为平面结构,C原子采取![]() 杂化;故答案为:
杂化;故答案为:![]() ;
;![]() 杂化;
杂化;![]() 与CO形成5个配位键,属于
与CO形成5个配位键,属于![]() 键,CO分子中形成1个
键,CO分子中形成1个![]() 键,故F
键,故F![]() 分子含有10个
分子含有10个![]() 键,1mol
键,1mol![]() 分子中含10mol
分子中含10mol![]() 键。CO含有2个原子14个电子,所以与CO互为等电子体的一种离子的化学式为
键。CO含有2个原子14个电子,所以与CO互为等电子体的一种离子的化学式为![]() 或
或![]() 、
、![]() 、
、![]() ,故答案为:10;
,故答案为:10;![]() ;
;![]() 据图知,
据图知,![]() 占据的是
占据的是![]() 围成的正四面体空隙和正八面体空隙,若
围成的正四面体空隙和正八面体空隙,若![]() 分子的原子坐标参数分别为
分子的原子坐标参数分别为![]() 0,
0,![]() ,
,![]() 0,
0,![]() ,
,![]() 1,
1,![]() 等,说明该晶胞的棱参数是1,则距离A位置
等,说明该晶胞的棱参数是1,则距离A位置![]() 分子最近的
分子最近的![]() 为形成的正四面体体心上的,为晶胞棱长的
为形成的正四面体体心上的,为晶胞棱长的![]() ,其参数为
,其参数为![]() ,故答案为:正四面体;正八面体;
,故答案为:正四面体;正八面体;![]() ;
;![]() 设晶体中
设晶体中![]() 与
与![]() 的最简整数比为x:y,根据
的最简整数比为x:y,根据![]() 中化合价代数和为零可知:
中化合价代数和为零可知:![]() ,解得x:
,解得x:![]() :
:![]() 晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“
晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“![]() ”,则晶体密度
”,则晶体密度![]() ,故答案为:8:3;
,故答案为:8:3;![]()