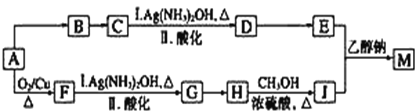
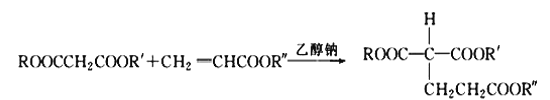题目内容
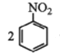
【题目】I.![]() 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用,请回答下列问题。
是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用,请回答下列问题。
(1)![]() 属于_____________(填:氧化物,碱,盐)。
属于_____________(填:氧化物,碱,盐)。
(2)浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示为:______________。(已知酸性:![]() -)
-)
(3)若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是_______。
II.Cl2是一种有毒气体,如果泄漏会造成严重的危害。
(4)已知:![]() ,化工厂可用浓氨水来检验Cl2是否泄漏。该反应中被氧化和未被氧化的
,化工厂可用浓氨水来检验Cl2是否泄漏。该反应中被氧化和未被氧化的![]() 的物质的量比_______。
的物质的量比_______。
(5)喷射石灰乳等碱性物质可以减轻少量Cl2泄漏造成的危害。Cl2和石灰乳反应的化学方程式是:_____。
【答案】盐 ![]()
![]() 1:3
1:3 ![]()
【解析】
(1)由金属阳离子与酸根离子构成,则NaClO属于盐;答案为盐。
(2)发生强酸制取弱酸的反应,生成HClO,离子方程式为ClO-+H2O+CO2=HClO+HCO3-,反应生成了HClO,漂白效果会更好;答案为:ClO-+H2O+CO2=HClO+HCO3-。
(3)将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,发生氧化还原反应生成氯气,离子反应为ClO-+Cl-+2H+=Cl2↑+H2O,氯气有毒,所以把“84”消毒液和某清洁剂(含盐酸)混合使用会发生中毒事故;答案为:ClO-+Cl-+2H+=Cl2↑+H2O。
(4)在3Cl2+8NH3=6NH4Cl+N2反应中,N元素的化合价由反应前NH3中的-3价变为反应后N2的0价,化合价升高,失去电子,被氧化,NH3作还原剂,根据化学方程式可知,8molNH3参加反应,有2mol作还原剂,有6mol的NH3未被氧化,所以该反应中被氧化的NH3和未被氧化的NH3的物质的量比为2:6=1:3;答案为:1:3。
(5)Cl2和石灰乳反应产生CaCl2、Ca(ClO)2和水,反应的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;答案为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。