题目内容
20. 太阳能电池的发展趋向于微型化、薄膜化.最新产品是铜镓(Ga)硒(Se)等化合物薄膜太阳能电池和Si系薄膜太阳能电池.完成下列填空:
太阳能电池的发展趋向于微型化、薄膜化.最新产品是铜镓(Ga)硒(Se)等化合物薄膜太阳能电池和Si系薄膜太阳能电池.完成下列填空:(1)亚铜离子(Cu+)基态时的电子排布式1s22s22p63s23p63d10;1mol配合离子[Cu(NH3)2]+中,含有σ键数目为8mol.
(2)已知硼元素与镓元素处于同一主族BF3分子的空间构型为平面正三角形,BF3与NH3以配位键结合生成BF3•NH3,该产物中B原子的杂化轨道类型为sp3.
(3)与硒同周期相邻的元素为砷和溴),则这三种元素的第一电离能从大到小顺序为Br>As>Se(用元素符号表示),H2Se的沸点比H2O的沸点低,其原因是H2O分子间存在氢键.
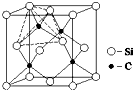
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构;在SiC中,每个Si原子周围最近的Si原子数目为12.
分析 (1)铜是29号元素,铜原子失去4s一个电子变成亚铜离子;配合离子[Cu(NH3)2]+中生成2个配位键,氨气分子之间形成3个σ键,配离子中含有8个σ键;
(2)BF3分子中B原子孤电子对数=$\frac{3-1×3}{2}$=0,价层电子对数=3+0=3;BF3与NH3以配位键结合生成BF3•NH3,该产物中B原子杂化轨道数目为4;
(3)同周期随原子序数增大,元素第一电离能呈增大趋势,As元素原子4p轨道为半满稳定状态,第一电离能高于同周期相邻元素的;
H2O分子间存在氢键,沸点高于硫化氢的;
(4)以顶点Si原子研究,与之最近的Si原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用.
解答 解:(1)铜是29号元素,铜原子失去4s一个电子变成亚铜离子,基态铜离子(Cu+)的电子排布式为:1s22s22p63s23p63d10,配合离子[Cu(NH3)2]+中生成2个配位键,氨气分子之间形成3个σ键,配离子中含有8个σ键,则1mol配合离子[Cu(NH3)2]+中,含有σ键数目为8mol,
故答案为:1s22s22p63s23p63d10;8mol;
(2)BF3分子中B原子孤电子对数=$\frac{3-1×3}{2}$=0,价层电子对数=3+0=3,空间结构为平面正三角形;BF3与NH3以配位键结合生成BF3•NH3,该产物中B原子杂化轨道数目为4,B原子杂化方式为:sp3,
故答案为:平面正三角形;sp3;
(3)同周期随原子序数增大,元素第一电离能呈增大趋势,As元素原子4p轨道为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:Br>As>Se,
H2O分子间存在氢键,沸点高于硫化氢的,
故答案为:Br>As>Se;H2O分子间存在氢键;
(4)以顶点Si原子研究,与之最近的Si原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故每个Si原子周围最近的Si原子数目为$\frac{3×8}{2}$=12,
故答案为:12.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式与空间构型判断、晶胞结构及计算等,注意同周期主族元素中第一电离能异常情况,掌握均摊法进行晶胞有关计算.

 优百分课时互动系列答案
优百分课时互动系列答案| A. | 改善能源结构,大力发展太阳能、风能等清洁能源 | |
| B. | 推广碳捕集和储存技术,逐步实现二氧化碳零排放 | |
| C. | 推广使用煤液化、气化技术,减少二氧化碳的排放 | |
| D. | 工业废水、生活污水净化处理,减少污染物的排放 |
| A. | 气态氢化物稳定性:R>Z>W | |
| B. | 原子半径:R<W<Y<Z<X | |
| C. | X分别与W、R形成的化合物的化学键类型不一定相同 | |
| D. | 电解X与R形成化合物的溶液可获得X的单质 |
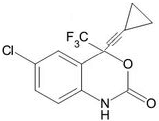
| A. | 该化合物中含有1个手性碳原子 | |
| B. | 该有机化合物分子式为:C14H8ClF3NO2 | |
| C. | 该化合物能发生水解、加成、氧化和消去反应 | |
| D. | 1mol该化合物与足量H2 反应,最多消耗5mol H2 |
| A. | NH3BH3中H元素均为+1价 | |
| B. | 合成反应中每生成1 mol NH3BH3会转移2 mol e- | |
| C. | 两个反应中,H2均既是氧化产物,又是还原产物 | |
| D. | 0.1 mol NH3BH3发生上述催化脱氢反应,一定生成6.72 L H2 |
| A. | 当达到化学平衡时,反应物已完全转化为生成物 | |
| B. | 化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏 | |
| C. | 当达到化学平衡时,反应混合物中各成分的浓度相等 | |
| D. | 当达到化学平衡时,正逆反应均已停止 |
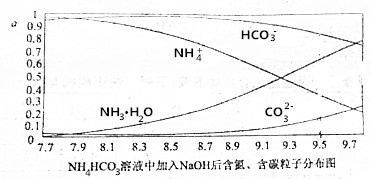
| A. | 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O | |
| B. | 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 | |
| C. | pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-) | |
| D. | 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |
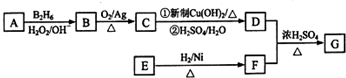
 .
.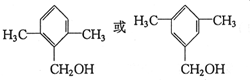 .
.
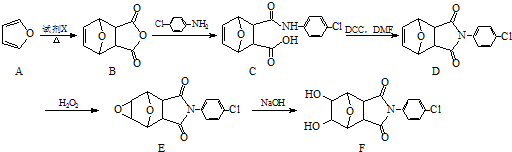
 ;②
;②
 )、羧基和醚键.(填名称)
)、羧基和醚键.(填名称) ;D→E的反应类型是氧化反应.
;D→E的反应类型是氧化反应.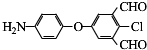 等.
等. )的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下: