题目内容
下列排列顺序正确的是( )
①热稳定性:NH3>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④结合质子能力:OH->CH3COO->Cl-
⑤晶体的熔点:Si3N4>NaCl>CCl4>SO2
①热稳定性:NH3>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④结合质子能力:OH->CH3COO->Cl-
⑤晶体的熔点:Si3N4>NaCl>CCl4>SO2
| A、③⑤ | B、①②④ |
| C、全部正确 | D、②④⑤ |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:①元素的非金属性越强,对应的氢化物越稳定;
②原子核外电子层数越多,半径越大,同周期元素从左到右,原子半径逐渐减小;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④化合物(酸)越弱,对应的阴离子越易结合氢离子;
⑤一般来说熔点:原子晶体>离子晶体>分子晶体;
②原子核外电子层数越多,半径越大,同周期元素从左到右,原子半径逐渐减小;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④化合物(酸)越弱,对应的阴离子越易结合氢离子;
⑤一般来说熔点:原子晶体>离子晶体>分子晶体;
解答:
解:①非金属性F>N>S,元素的非金属性越强,对应的氢化物越稳定,故①错误;
②原子核外电子层数越多,半径越大,同周期元素从左到右,原子半径逐渐减小,故②正确;
③非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故③错误;
④酸性HCl>CH3COOH>H2O,化合物(酸)越弱,对应的阴离子越易结合氢离子,故④正确;
⑤一般来说熔点:原子晶体>离子晶体>分子晶体,同为分子晶体的CCl4和SO2在室温下分别为液态、气态.故⑤正确;
故选D.
②原子核外电子层数越多,半径越大,同周期元素从左到右,原子半径逐渐减小,故②正确;
③非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故③错误;
④酸性HCl>CH3COOH>H2O,化合物(酸)越弱,对应的阴离子越易结合氢离子,故④正确;
⑤一般来说熔点:原子晶体>离子晶体>分子晶体,同为分子晶体的CCl4和SO2在室温下分别为液态、气态.故⑤正确;
故选D.
点评:本题考查元素周期表和元素周期律的应用,为高频考点,把握元素的位置、性质的变化规律为解答的关键,侧重金属性、非金属性比较的考查,题目难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目
下列反应中,水为氧化剂的是( )
| A、Cl2+H2O═HCl+HClO |
| B、2Na+2H2O═2NaOH+H2↑ |
| C、P2O5+3H2O═2H3PO4 |
| D、3NO2+H2O═2HNO3+NO |
将质量分数为30%的硫酸与90%的硫酸等体积混合后,混合液的质量分数为( )
| A、60% | B、>60% |
| C、<60% | D、无法确定 |
苯环上有两个侧链烃基的有机物C12H18,其同分异构体的数目为(不考虑立体异构)( )
| A、39 | B、42 | C、45 | D、48 |
硒是人体中14种必需的营养元素之一,被誉为“生命的奇效元素”,下列关于硒的叙述中错误的是( )
| A、硒的原子半径比氧原子大 |
| B、H2Se沸点比H2O高 |
| C、硒的非金属性比氧元素弱 |
| D、硒的最高价氧化物对应水化物的化学式为H2SeO4 |
碳纳米管为单、双键交替共轭结构,电子传输效果很好,可用作导电材料.现有1根由180个碳原子构成的碳纳米管,若要将这根C180的碳纳米管完全氢化形成C180H180,则放出的热量约为(已知1mol碳碳双键氢化时约放热120kJ)( )
| A、1.79×10-20 kJ |
| B、3.59×10-20 kJ |
| C、1.08×104kJ |
| D、2.16×104kJ |
在一个固定体积的密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(g)?3C(g)十D(s),达到平衡时C的浓度为1.2mol/L.若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2mol/L的是( )
| A、4 mol A+2 mol B |
| B、3 mol C+1 mol D+l mol B |
| C、3 mol C+0.8 molD |
| D、1.6 mol A+0.8 mol B+0.6 mol C+0.2 mol D |
将3mol A和1mol B混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,发生了如下反应:3A(g)+B(g)?2C(g)+D(g),达到平衡时C的浓度为w mol/L保持温度和压强不变,按下列四种配比充入容器P中,平衡后C的浓度仍为w mol/L的是( )
| A、6molA+2molB |
| B、3molA+1molB+2molC |
| C、2molC+1molB+1molD |
| D、1molC+2molD |
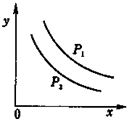 反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断上述反应是
反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断上述反应是