题目内容
在用浓硫酸配制稀硫酸过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?(在后面横线上“偏高”、“偏低”、“无影响”).
Ⅰ、用量筒量取浓硫酸时俯视凹液面
Ⅱ、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
Ⅲ、定容时仰视刻度线
Ⅳ、转移时容量瓶中有少量蒸馏水 .
Ⅰ、用量筒量取浓硫酸时俯视凹液面
Ⅱ、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
Ⅲ、定容时仰视刻度线
Ⅳ、转移时容量瓶中有少量蒸馏水
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:依据C=
分析,凡是能够使n偏小或者使V偏大的操作都会使溶液的浓度偏小,反之,溶液的浓度偏大.
| n |
| V |
解答:
解:Ⅰ.用量筒量取浓硫酸时俯视凹液面,量取的浓硫酸偏少,溶质的物质的量偏小,溶液的浓度偏低,故答案为:偏低;
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液的体积偏大,溶液的浓度偏低,故答案为:偏低;
Ⅲ.定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏低,故答案为:偏低;
Ⅳ.转移时容量瓶中有少量蒸馏水,对n和V都不产生影响,溶液的浓度不变,故答案为:无影响.
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液的体积偏大,溶液的浓度偏低,故答案为:偏低;
Ⅲ.定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏低,故答案为:偏低;
Ⅳ.转移时容量瓶中有少量蒸馏水,对n和V都不产生影响,溶液的浓度不变,故答案为:无影响.
点评:本题考查了配制一定物质的量浓度溶液,明确配制的步骤和误差分析的方法是解题关键,注意容量瓶的构造和使用方法,题目难度不大.

练习册系列答案
相关题目
室温时,0.1mol?L-1的HA溶液的pH=3,向该溶液中逐滴加入0.1mol?L-1 NaOH溶液,在滴加过程中,有关叙述正确的是( )
| A、未加入NaOH溶液时,原HA溶液中c(H+)=c(OH-)+c(A-) |
| B、向原溶液中滴入少量NaOH溶液,离子浓度可能为:c(A-)>c(Na+)>c(H+)>c(OH-) |
| C、当滴入的NaOH与HA恰好完全中和时,溶液中c(Na+)=c(A-) |
| D、当加入过量的NaOH溶液时,溶液可能呈中性,也可能呈碱性 |
用H2O2和H2SO4的混合溶液可溶解废旧印刷电路板上的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ?mol -11H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ?mol -1H2(g)+
O2(g)═H2O(l))△H=-285.84kJ?mol -1在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热△H等于( )
| 1 |
| 2 |
| A、-417.91kJ?mol -1 |
| B、-319.68kJ?mol -1 |
| C、+546.69kJ?mol -1 |
| D、-448.46kJ?mol -1 |
下列实验装置图正确的是( )
A、 |
B、 |
C、 |
D、 |
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
| A、A、C两种元素可组成化学式为CA3的化合物 |
| B、F与D形成的化合物性质很不活泼,不与任何酸反应 |
| C、原子半径大小顺序是E<F<C<D |
| D、非金属性强弱顺序是D>C>F>B |
近日来,全国安全事故频发,折射出人们对化学品与安全知识的极度缺乏,下列有关化学品与安全的说法或操作错误的是( )
A、运石油的油罐车上应贴  标志,装运浓硫酸的槽罐车应贴 标志,装运浓硫酸的槽罐车应贴  标志,并由专人押运 标志,并由专人押运 |
| B、欲往燃烧的酒精炉中添加酒精必须要先熄灭酒精炉并等酒精炉完全冷却后才能加入酒精 |
| C、炒菜时油锅着火,立即加水灭火;电器起火时,应立即切断电源并采取适当措施灭火 |
| D、若家中出现煤气泄露,会闻到浓烈的气味,应马上开窗通风,切不可打电话或打开其他电器. |
关甲烷的图示中不能反映甲烷分子为立体结构的是( )
A、结构式: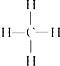 |
B、球棍模型: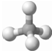 |
C、比例模型: |
D、分子结构示意图: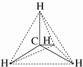 |