题目内容
9.下列变化中,不属于化学变化的是( )| A. | 石墨变成金刚石 | B. | 胆矾(CuSO4•5H2O)失去结晶水 | ||
| C. | 氯气变成液氯 | D. | 白磷转化为红磷 |
分析 有新物质生成的变化叫化学变化,没有新物质生成的变化叫物理变化.化学变化的特征是:有新物质生成.判断物理变化和化学变化的依据是:是否有新物质生成.
解答 解:A.石墨和金刚石结构不同,转化过程中生成了新的物质,属于化学变化,故A不符合;
B.胆矾(CuSO4•5H2O)失去结晶水发生的是化学反应,过程中生成了新的物质属于化学变化,故B不符合;
C.氯气变成液氯是物质状态变化,过程中无新物质生成属于物理变化,故C符合;
D.白磷转化为红磷是同素异形体转化,属于化学反应,故D不符合;
故选C.
点评 本考点考查了物理变化和化学变化的区别,基础性比较强,只要抓住关键点:是否有新物质生成,问题就很容易解决,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
19.下列说法正确的是( )
| A. | SiO2既能与HF反应,又能与NaOH反应,因此是两性氧化物 | |
| B. | SO2与Cl2均可漂白物质,将二者等物质的量混合,漂白效果会加强 | |
| C. | 将足量Na投入FeCl3溶液中,可将Fe3+直接还原为Fe单质 | |
| D. | 1 mol Na2O2与足量的CO2反应,转移电子的物质的量为1 mol |
20.下列有机物属于烷烃的是( )
| A. | C2H4 | B. | C4H6 | C. | C3H8 | D. | C6H6 |
17.将20g Ba(OH)2•8H2O晶体与10g NH4Cl晶体一起放入小烧杯中,并将烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌晶体.则下列说法正确的是( )
| A. | 实验中玻璃棒的作用是加速固体溶解 | |
| B. | 玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应 | |
| C. | 反应中断开化学键吸收的总能量低于形成化学键放出的总能量 | |
| D. | 该反应中,反应物的总能量小于生成物的总能量 |
4.铜锌原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
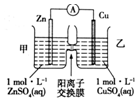

| A. | 锌电极上发生的反应: | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 电流由锌电极经电流表流向铜电极 | |
| D. | 电池工作一段时间后,乙池溶液的总质量增加 |
14.某试剂能把乙醇、乙酸、葡萄糖溶液区别开,这种试剂是( )
| A. | 新制Cu(OH)2悬浊液 | B. | 溴水 | ||
| C. | 钠 | D. | 酸性高锰酸钾溶液 |
1.将H2SO4,Na2CO3,Ba(OH)2三种溶液,两两混合后,恰好完全反应,对有沉淀生成的分别进行过滤,所得滤液的酸碱性叙述正确的是( )
| A. | 一种滤液显碱性,另一种滤液显中性 | |
| B. | 两种滤液均显碱性 | |
| C. | 一种滤液显碱性,另一种滤液显酸性 | |
| D. | 两种滤液均显酸性 |
18.欲将蛋白质从水中析出而又不改变它的性质,应加入( )
| A. | 甲醛溶液 | B. | 酒精 | C. | 饱和(NH4)2SO4溶液 | D. | 醋酸铅溶液 |
19.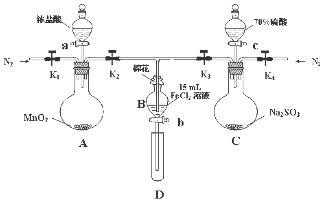 为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中继续通入N2,然后关闭K1、K3、K4
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
IV.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰.
(2)棉花中浸润的溶液化学式为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为KSCN溶液和铁氰化钾(或K3[FeCN6])溶液.若确定有Fe3+ 和Fe2+,则现象分别是溶液变红和产生蓝色沉淀.
(5)过程Ⅵ,检验B溶液中含有SO42-的操作是.
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是乙、丙(填“甲”“乙”“丙”).
 为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中继续通入N2,然后关闭K1、K3、K4
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
IV.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰.
(2)棉花中浸润的溶液化学式为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为KSCN溶液和铁氰化钾(或K3[FeCN6])溶液.若确定有Fe3+ 和Fe2+,则现象分别是溶液变红和产生蓝色沉淀.
(5)过程Ⅵ,检验B溶液中含有SO42-的操作是.
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是乙、丙(填“甲”“乙”“丙”).
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |