题目内容
将11.2L标准状况下的甲烷和乙烯的混合气体通入足量的溴的四氯化碳溶液中充分反应,溴的四氯化碳溶液增加了5.6g,求原混合气体中甲烷与乙烯的质量之比.
考点:有关混合物反应的计算
专题:计算题
分析:乙烯与溴发生加成反应,溴的四氯化碳溶液增加的质量为乙烯的质量,计算混合气体、乙烯的物质的量,进而计算甲烷的物质的量,再计算甲烷的质量,据此解答.
解答:
解:乙烯与溴发生加成反应,溴的四氯化碳溶液增加的质量为5.6g,则:m(C2H4)=5.6g,n(C2H4)=
=0.2mol,
而n(CH4)+n(C2H4)=
=0.5mol,所有n(CH4)=0.5mol-0.2mol=0.3mol,故m(CH4)=0.3mol×16g/mol=4.8g,
故原混合气体中甲烷与乙烯的质量之比=4.8g:5.6g=6:7,
答:原混合气体中甲烷与乙烯的质量之比为6:7.
| 5.6g |
| 28g/mol |
而n(CH4)+n(C2H4)=
| 11.2L |
| 22.4l/mol |
故原混合气体中甲烷与乙烯的质量之比=4.8g:5.6g=6:7,
答:原混合气体中甲烷与乙烯的质量之比为6:7.
点评:本题考查混合物计算,比较基础,关键是明确乙烯与溴发生加成反应确定乙烯的质量.

练习册系列答案
相关题目
下列说法正确的是( )
A、反应2Mg+CO2
| ||||
| B、pH=4的0.1mol?L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | ||||
| C、实验表明,相同温度下,液态纯硫酸的导电性强于纯水.已知液态电解质都能像水那样自身电离而建立电离平衡,且在一定温度下都有各自的离子积常数.25℃时,纯硫酸的离子积常数K和水的离子积常数Kw关系为K<Kw | ||||
| D、标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为6.02×1023 |
将一块镁铝合金溶于盐酸后,再加入过量NaOH溶液,所得的溶液中主要存在的离子是( )
| A、AlO2-、OH-、Na+、Cl- |
| B、Na+、OH-、Al3+、Cl- |
| C、AlO2-、OH-、Mg2+、Cl- |
| D、Na+、Mg2+、Al3+、Cl- |


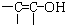 结构的物质)
结构的物质)