题目内容
为测定某有机化合物X的结构,进行如下实验:
(1)取一定量有机物X在氧气中完全燃烧,测得生成8.8g CO2和3.6g H2O,消耗标准状况下的氧气5.6L,则X中含有 种元素.
(2)用质谱仪测得A的相对分子质量为44,则X的分子式为 .
(3)根据价键理论,试写出X可能的结构简式(不考虑含有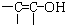 结构的物质) .
结构的物质) .
(4)X的核磁共振氢谱中出现两个不同位置的峰,则X与氢气反应的化学方程式是 .
(1)取一定量有机物X在氧气中完全燃烧,测得生成8.8g CO2和3.6g H2O,消耗标准状况下的氧气5.6L,则X中含有
(2)用质谱仪测得A的相对分子质量为44,则X的分子式为
(3)根据价键理论,试写出X可能的结构简式(不考虑含有
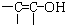 结构的物质)
结构的物质)(4)X的核磁共振氢谱中出现两个不同位置的峰,则X与氢气反应的化学方程式是
考点:有机物实验式和分子式的确定
专题:有机化学基础
分析:(1)有机物燃烧生成二氧化碳和水,证明含有C、H元素,根据质量守恒来确定是否含氧元素;
(2)根据燃烧法结合元素守恒确定有机物的分子式;
(3)根据化学式结合元素的价键理论来书写结构简式;
(4)X的核磁共振氢谱中出现两个不同位置的峰,证明含有两种不同类型的氢原子,据此回答.
(2)根据燃烧法结合元素守恒确定有机物的分子式;
(3)根据化学式结合元素的价键理论来书写结构简式;
(4)X的核磁共振氢谱中出现两个不同位置的峰,证明含有两种不同类型的氢原子,据此回答.
解答:
解:(1)有机物X在氧气中完全燃烧,测得生成8.8g即0.2mol CO2和3.6g 即0.2molH2O,证明含有C、H元素,消耗标准状况下的氧气5.6L即0.25mol,消耗氧气中的氧原子为0.5mol,产物中的氧原子是0.2mol×2+0.2mol×1=0.6mol>0.5mol,所以有机物中含有氧原子,故有机物中含有C、H、O三种元素,故答案为:3;
(2)有机物X在氧气中完全燃烧,测得生成8.8g即0.2molCO2和3.6g即0.2molH2O,证明含有C、H元素物质的量分别是0.2mol,0.4mol,含有氧原子的物质的量是0.6mol-0.5mol=0.1mol,A的相对分子质量为44,则分子式为:C2H4O;
(3)根据价键理论,试写出X可能的结构简式为:CH3CHO或 ,故答案为:CH3CHO或
,故答案为:CH3CHO或 ;
;
(4)X的核磁共振氢谱中出现两个不同位置的峰,证明含有两种不同类型的氢原子,X的结构简式为:CH3CHO,和氢气的反应为:CH3CHO+H2
CH3CH2OH,故答案为:CH3CHO+H2
CH3CH2OH.
(2)有机物X在氧气中完全燃烧,测得生成8.8g即0.2molCO2和3.6g即0.2molH2O,证明含有C、H元素物质的量分别是0.2mol,0.4mol,含有氧原子的物质的量是0.6mol-0.5mol=0.1mol,A的相对分子质量为44,则分子式为:C2H4O;
(3)根据价键理论,试写出X可能的结构简式为:CH3CHO或
 ,故答案为:CH3CHO或
,故答案为:CH3CHO或 ;
; (4)X的核磁共振氢谱中出现两个不同位置的峰,证明含有两种不同类型的氢原子,X的结构简式为:CH3CHO,和氢气的反应为:CH3CHO+H2
| 催化剂 |
| △ |
| 催化剂 |
| △ |
点评:本题目是一道关于有机物的化学式的确定的知识题目,注意燃烧法在确定有机物分子式中的重要作用,难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
| A、取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| B、取a克混合物与足量稀硫酸充分反应,逸出气体未经干燥用碱石灰吸收,增重b克 |
| C、取a克混合物充分加热至恒重,减重b克 |
| D、取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
