题目内容
50mL质量分数为35%、密度为1.24g/mL的硫酸中,硫酸的物质的量浓度为( )
| A、0.044mol/L |
| B、0.44mol/L |
| C、4.4mol/L |
| D、44mol/L |
考点:物质的量浓度的相关计算
专题:
分析:根据物质的量浓度与溶质质量分数的转化关系:c=
计算出该硫酸的物质的量浓度.
| 1000ρω |
| M |
解答:
解:该硫酸的物质的量浓度为:c=
=
mol/L≈4.4mol/L,
故选C.
| 1000ρω |
| M |
| 1000×1.24×35% |
| 98 |
故选C.
点评:本题考查了物质的量浓度的计算,侧重了基础知识的考查,题目难度不大,明确物质的量浓度与溶质质量分数的关系为解答关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
加热蒸干下列物质的溶液并灼烧,可以得到该物质固体的是( )
| A、硫酸铝 | B、碳酸氢钠 |
| C、硫化铵 | D、氯化铝 |
下列类比关系正确的是( )
| A、Fe在冷的浓硝酸中发生钝化,Cu在冷的浓硝酸中也发生钝化 |
| B、Na2O2 与CO2反应生成Na2CO3和O2,与SO2反应可生成Na2SO3和O2 |
| C、Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 |
| D、Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应 |
将10mL 5mol?L-1的盐酸稀释到200mL,则此时溶液的物质的量浓度是( )
| A、0.05 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.10 mol?L-1 |
| D、0.50 mol?L-1 |
下列说法或表达正确的是( )
①次氯酸的结构式为 H-Cl-O
②含有离子键的化合物都是离子化合物
③蛋白质、漂白粉、苛性钾、液氨分别为纯净物、混合物、强电解质和非电解质
④丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应
⑤酸性氧化物不一定是非金属氧化物,但是碱性氧化物一定是金属氧化物.
①次氯酸的结构式为 H-Cl-O
②含有离子键的化合物都是离子化合物
③蛋白质、漂白粉、苛性钾、液氨分别为纯净物、混合物、强电解质和非电解质
④丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应
⑤酸性氧化物不一定是非金属氧化物,但是碱性氧化物一定是金属氧化物.
| A、①②④ | B、①③⑤ |
| C、②④⑤ | D、③④⑤ |
具有相同电子层数的X、Y、Z三种元素,已知它们最高价氧化物对应水化物酸性由强到弱的顺序是HXO4、H2YO4、H3ZO4,则下列判断不正确的是( )
| A、X、Y、Z三种元素在周期表中的位置依次是ⅦA、ⅥA、ⅤA |
| B、原子半径X>Y>Z |
| C、元素原子的得电子能力X>Y>Z |
| D、气态氢化物的化学式依次是HX、H2Y、ZH3 |
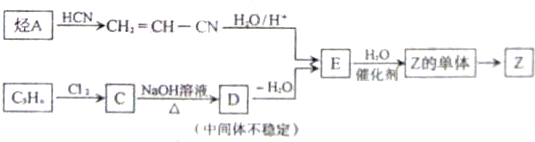

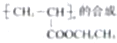 实验,此实验过程涉及的反应类型有
实验,此实验过程涉及的反应类型有