题目内容
3.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:(1)A元素是K、B元素是Cl、C元素是S(用元素符号表示)
(2)D是由两种元素组成的双原子分子,其分子式是HCl.
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是F2.
(4)F是由两种元素组成的三原子分子,其分子式是H2S,电子式是
 .
.(5)G分子中含有4个原子,其分子式是H2O2或PH3.
分析 18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等,结合题目所给条件,即可确定所需答案.
解答 解:18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等,
(1)含有18e-的A+、B-、C2-分别为K+、Cl-、S2-,所以A元素为K,B元素为Cl,C元素为S,
故答案为:K、Cl、S;
(2)18e-微粒中由两种元素组成的双原子分子为HCl,
故答案为:HCl;
(3)含18个电子的微粒中氧化能力最强的为F2,
故答案为:F2;
(4)由两种元素组成的三原子分子为H2S,电子式为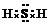 ,
,
故答案为:H2S;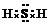 ;
;
(5)含有4个原子的18e-微粒中,分子式为H2O2或PH3,
故答案为:H2O2或PH3.
点评 本题考查18电子微粒的结构和性质,题目难度不大,本题注意常见10电子和18电子微粒,把握相关物质的性质.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
3.NA表示阿伏德罗常数的额值,下列说法正确的是( )


| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.5mol雄黄(As4S4,结构如图),含有NA个As-S键 |
4.用NA表示表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,0.05NA个CO2分子所占的体积是1.12L | |
| B. | 1mol 氧气所含有的原子数为NA | |
| C. | 常温常压下,32g O2和34g H2S气体分子个数比为1:1 | |
| D. | 11.2L NH3中所含的质子数为5NA |
11.某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)
已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.

(1)配平制备ClO2的化学方程式:2KClO3+1H2C2O4--2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应,逸出的CO2与NaOH溶液反应生成Na2CO3或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请在答题卷上写出实验步骤以及预期现象和结论.限选实验试剂:1mol•L-1 H2SO4、0.1mol•L-1 HCl、0.01mol•L-1 KMnO4、澄清石灰水.
已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.

(1)配平制备ClO2的化学方程式:2KClO3+1H2C2O4--2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应,逸出的CO2与NaOH溶液反应生成Na2CO3或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请在答题卷上写出实验步骤以及预期现象和结论.限选实验试剂:1mol•L-1 H2SO4、0.1mol•L-1 HCl、0.01mol•L-1 KMnO4、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl . | 沉淀全部溶解,有气泡产生,说明沉淀中有CaCO3 |
步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4 . | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
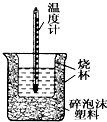 50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: ;
; .
.