题目内容
1.下列实验设计与结论不相符的是( )| A. | 某溶液中加入Ba(NO3)2溶液,再滴加稀盐酸,出现白色沉淀且不溶解,则原溶液中可能含有SO32- | |
| B. | 某气体使湿润的蓝色试纸变红,则该气体一定是酸性氧化物 | |
| C. | 乙醇中混有乙酸,加入氢氧化钠后蒸馏即得纯净的乙醇 | |
| D. | 在分液漏斗中加入溴水,然后加入适量CCl4,振荡后静置,溴可萃取到CCl4中 |
分析 A.白色沉淀为硫酸钡,可能酸性条件下亚硫酸根离子被氧化生成硫酸根离子;
B.气体使湿润的蓝色试纸变红,可能为HCl;
C.乙酸与NaOH反应后,增大与乙醇的沸点差异;
D.溴不易溶于水,易溶于四氯化碳.
解答 解:A.白色沉淀为硫酸钡,可能酸性条件下亚硫酸根离子被氧化生成硫酸根离子,则原溶液中可能含有SO32-,故A正确;
B.气体使湿润的蓝色试纸变红,可能为HCl,不一定为酸性氧化物,故B错误;
C.乙酸与NaOH反应后,增大与乙醇的沸点差异,然后蒸馏得到乙醇,故C正确;
D.溴不易溶于水,易溶于四氯化碳,溴水中加入适量CCl4,振荡后静置,溴可萃取到CCl4中,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握离子检验、气体的检验、混合物分离提纯、实验技能为解答的关键,选项B为解答的易错点,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
13.将20gNaHCO3 固体加热一段时间,冷却、称量剩余固体质量为13.8g,则此NaHCO3 的分解百分率为( )
| A. | 84% | B. | 42% | C. | 53% | D. | 67% |
12.将A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s)?2C(g),忽略固体体积,平衡时C的体积分数(%)随温度和压强的变化如下表所示:
①a<b;
②该反应的熵变△S<0;
③900℃、2.0MPa时E的转化率为60%;
④K(1000℃)>K(800℃);
⑤正反应为吸热反应.
上述①~⑤中正确的有( )
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 800 | 54.0 | a | b |
| 900 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
②该反应的熵变△S<0;
③900℃、2.0MPa时E的转化率为60%;
④K(1000℃)>K(800℃);
⑤正反应为吸热反应.
上述①~⑤中正确的有( )
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
9. 实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ、配制0.50mol/L KOH溶液:
若实验中大约要使用230mL KOH溶液,至少需要称量KOH固体7.0g.
Ⅱ、测定稀硫酸与氢氧化钾溶液反应的中和热:
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、量筒、环形玻璃搅拌棒,尚缺少的玻璃仪器是温度计.
(2)取50mL KOH溶液和30mL硫酸溶液进行实验,实验数据如表:
①请填写表中的空白:
②近似认为0.50mol/L KOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容为c=4.18J/(g•℃),则中和热△H=-53.50 kJ•mol-1.
(3)某同学进行该实验时未找到环形玻璃搅拌棒,实验中他用铜丝代替环形玻璃棒进行搅拌,测得的中和热的数值会偏小(填“偏大”“偏小”或“无影响”),原因是:铜丝是热的良导体,导致热量散失.
Ⅲ、某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(填一种即可).
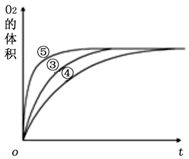
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ、配制0.50mol/L KOH溶液:
若实验中大约要使用230mL KOH溶液,至少需要称量KOH固体7.0g.
Ⅱ、测定稀硫酸与氢氧化钾溶液反应的中和热:
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、量筒、环形玻璃搅拌棒,尚缺少的玻璃仪器是温度计.
(2)取50mL KOH溶液和30mL硫酸溶液进行实验,实验数据如表:
①请填写表中的空白:
| 项目 数据 次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值 (T2-T1)/℃ | ||
| H2SO4 | KOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 | |
(3)某同学进行该实验时未找到环形玻璃搅拌棒,实验中他用铜丝代替环形玻璃棒进行搅拌,测得的中和热的数值会偏小(填“偏大”“偏小”或“无影响”),原因是:铜丝是热的良导体,导致热量散失.
Ⅲ、某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol•L-1 X溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
16.将标准状况下6.72L的CO2通入含14.8g Ca(OH)2的石灰水中,所得沉淀的质量是( )
| A. | 1 g | B. | 10 g | C. | 20 g | D. | 30 g |
6.将含有O2和CH4的混合气体置于盛有23.4g Na2O2的密闭容器中,电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中,无气体产生.下列叙述不正确的是( )
| A. | 原混合气体中O2和CH4的体积比为2:1 | |
| B. | 残留物中只有Na2CO3和NaOH | |
| C. | 反应中电子转移总数为0.8NA | |
| D. | 残留物质量为26.6克 |
10.下列关于有机化合物的说法中,正确的是( )
| A. | CH3CH2=CHCOOH能发生加成、取代、氧化反应 | |
| B. | 油脂、淀粉、纤维素都属于天然高分子化合物 | |
| C. | 蛋白质溶液加入CuSO4溶液会析出,这一过程属于蛋白质的盐析 | |
| D. | 甲苯和乙烯都可与溴水发生化学反应使溴水褪色 |
11.乙烷和溴在一定条件下发生取代反应,理论上得到的溴化物最多有( )
| A. | 1种 | B. | 6 种 | C. | 9 种 | D. | 10种 |