题目内容
可逆反应2A(g)?B(g)△H<0 从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该变化过程中各物质的浓度(用c表示)随时间变化情况如下图所示:试分析各图,指出导致平衡移动的因素和平衡移动的方向:

A:平衡移动的因素: ,平衡移动的方向:
B:平衡移动的因素:
C;平衡移动的方向; .

A:平衡移动的因素:
B:平衡移动的因素:
C;平衡移动的方向;
考点:化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:已知可逆反应2A(g)?B(g)△H<0,该反应正方向为放热的、体积减小的反应,根据温度及压强对平衡的影响分析.
解答:
解:已知可逆反应2A(g)?B(g)△H<0,该反应正方向为放热的、体积减小的反应;
A:图象A中改变条件后,反应物A的浓度增大,生成物B的浓度减小,则平衡逆向移动,AB的浓度是逐渐增大的,所以改变的条件不是浓度或压强,则改变的条件是升高温度;
故答案为:升高温度;逆向;
B:图象B中改变条件后,反应物AB的浓度都突然增大,则改变的条件是缩小体积,即增大了压强;
故答案为:增大压强;
C:图象B中改变条件后,反应物AB的浓度都突然减小,则改变的条件是扩大体积,即减小了压强,减小压强平衡向体积增大的方向进行,即逆向进行;
故答案为:逆向.
A:图象A中改变条件后,反应物A的浓度增大,生成物B的浓度减小,则平衡逆向移动,AB的浓度是逐渐增大的,所以改变的条件不是浓度或压强,则改变的条件是升高温度;
故答案为:升高温度;逆向;
B:图象B中改变条件后,反应物AB的浓度都突然增大,则改变的条件是缩小体积,即增大了压强;
故答案为:增大压强;
C:图象B中改变条件后,反应物AB的浓度都突然减小,则改变的条件是扩大体积,即减小了压强,减小压强平衡向体积增大的方向进行,即逆向进行;
故答案为:逆向.
点评:本题考查了化学平衡图象,注意准确把握温度、压强对平衡的影响是解决本题的关键,题目难度不大.

练习册系列答案
相关题目
张清莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值.In的一种核素为49115In,它的中子数与质子数之差为( )
| A、49 | B、115 | C、66 | D、17 |
下列说法正确的是( )
| A、同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 | ||||||
| B、任何元素的原子都是由核外电子和核内中子、质子构成的 | ||||||
| C、钠原子失去一个电子后,它的电子数与氖原子相同,变成10e-微粒 | ||||||
D、
| ||||||
E、
|
下列叙述中正确的是(NA代表阿伏加德罗常数的值)( )
| A、常温常压下,0.1mol/L CH3COOH中所含H+数目为0.1NA |
| B、78gNa2O2与水充分反应,转移的电子数为2NA |
| C、25℃时,1L pH=13的Ba(OH)2溶液中由水电离产生的OH-数目为0.1NA |
| D、电解精炼铜时,若电池中转移2NA个电子,则阴极质量增加64g |
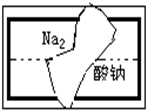 某研究性学习小组在整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶标签破损(如图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出三种猜想,并设计实验验证,写出每一种猜想的实验操作、现象和结论.
某研究性学习小组在整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶标签破损(如图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出三种猜想,并设计实验验证,写出每一种猜想的实验操作、现象和结论.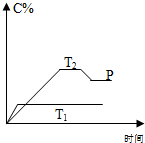 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
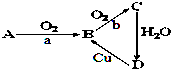 如图为A、B、C、D四种物质的转化关系,a、b为反应条件,
如图为A、B、C、D四种物质的转化关系,a、b为反应条件,