题目内容
18.用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )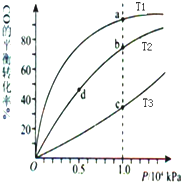
| A. | 温度:T1>T2>T3 | B. | 平衡常数:K(a)>K(c) K(b)=K(d) | ||
| C. | 正反应速率:v(a)>v(c) v(b)>v(d) | D. | 平均摩尔质量:M(a)<M(c) M(b)>M(d) |
分析 A.该反应为放热反应,温度越低,CO的转化率越大;
B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,K值增大,平衡常数只与温度有关,b、d两点温度相同,平衡常数相同;
C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快;b、d两点压强相同,温度越高,反应速率越大;
D.CO转化率的越大,n总越小,由M=$\frac{m}{n}$判断.
解答 解:A.该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A错误;
B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,则K(a)>K(c),平衡常数只与温度有关,b、d两点温度相同,平衡常数相同,则K(b)=K(d),故B正确;
C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快,故υ(a)<υ(c).b、d两点温度相同,压强越大,反应速率越大,b点大于d点压强,则v(b)>v(d),故C错误;
D.CO转化率的越大,n总越小,由M=$\frac{m}{n}$可知,a点n总小,则M(a)>M(c),M(b)>M(d),故D错误;
故选B.
点评 本题考查温度、压强、转化率等之间的关系,明确外界条件对反应速率及平衡的影响是解本题的关键,易错选项是D,注意根据M=$\frac{m}{n}$来分析解答即可.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
18.可逆反应mA(s)+nB(g)?pC(g)+qD(g)△H=Q kJ•mol-1在反应过程中,当其它条件不变时,C的体积分数Φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )
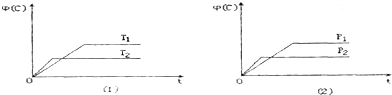

| A. | T1>T2 P1>P2 | B. | Q>0 | ||
| C. | m+n<p+q | D. | 该反应一定具有自发性 |
19.最近日本古河株式会社推出应急救援用电池-MgBOX(如图所示),通过空气和金属镁发生化学反应产生电能,使用时只要将水或海水倒人纸盒即可发电,下列有关说法正确( )

| A. | 正极发生的电极反应为Mg-2e-=Mg2+ | |
| B. | 电池工作时,海水中的Cl-向镁电极移动 | |
| C. | 使用时也可以向其中加入食醋发电 | |
| D. | 电池的总反应为2Mg+O2=2MgO |
6.(1)锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图1所示,其中电解质LiCIO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
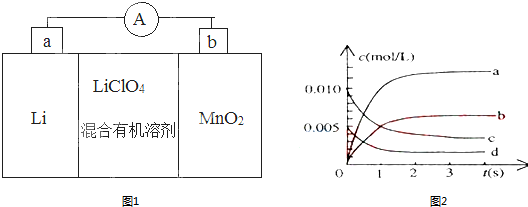
①外电路的电流方向是由b极流向a极.(填字母)
②电池正极反应式为MnO2+e?+Li+═LiMnO2.
③是否可用水代替电池中的混合有机溶剂?否(填“是”或“否”),原因是_电极Li是活泼金属,能与水反应.
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
①如图2中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•S-1.
②为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂.

①外电路的电流方向是由b极流向a极.(填字母)
②电池正极反应式为MnO2+e?+Li+═LiMnO2.
③是否可用水代替电池中的混合有机溶剂?否(填“是”或“否”),原因是_电极Li是活泼金属,能与水反应.
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
②为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂.
3.下列图示与对应的叙述相符的是( )
| A. | 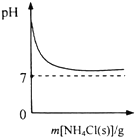 表示向NH3•H2O溶液中逐步加入NH4Cl固体后,溶液pH的变化 | |
| B. | 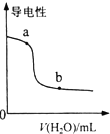 表示向NH3•H2O溶液中加水时溶液的导电性变化,则NH3•H2O溶液的pH:b>a | |
| C. | 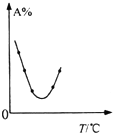 表示等量A在容积相同的恒容密闭容器中,不同温度下分别发生反应:2A(g)?B(g)+C(g),相同时间后测得A含量的曲线,则该反应的△H<0 | |
| D. | 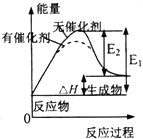 表示催化剂能改变化学反应的焓变 |
10.下列各组中的物质相互反应时,无论哪种过量,都可用同一个离子方程式表示的是
①碳酸钠溶液与盐酸 ②硫酸铝溶液与氨水 ③二氧化碳气体与苯酚钠溶液
④硝酸银溶液与氨水 ⑤碘化亚铁溶液与氯水 ⑥碳酸氢钙溶液与澄清石灰水( )
①碳酸钠溶液与盐酸 ②硫酸铝溶液与氨水 ③二氧化碳气体与苯酚钠溶液
④硝酸银溶液与氨水 ⑤碘化亚铁溶液与氯水 ⑥碳酸氢钙溶液与澄清石灰水( )
| A. | ②③⑥ | B. | ①③⑥ | C. | ②④ | D. | ③⑤ |
7.下列离子方程式中书写正确的是( )
| A. | 固体氯化铵和消石灰混合并加热 NH4++OH-═MH3↑+H20 | |
| B. | 氨水通人过量的二氧化碳 NH3•H20+CO2═NH4++HCO3- | |
| C. | 磷酸二氢钙溶液中加入过量的氢氧化钙 2H2PO4-+3Ca2++40H-═Ca3(PO4)2↓+4H2O | |
| D. | 硫化亚铁与盐酸反应 S2-+2H+═H2S↑ |
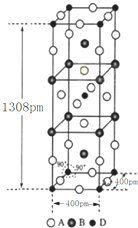 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: .
.