题目内容
下列叙述中正确的是( )


| A、图①中正极附近溶液pH降低 |
| B、图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| C、图②正极反应是O2+2H2O+4e-═4OH- |
| D、图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:图①锌为负极,铜为正极,正极铜离子放电生成铜,图②铁为负极,铜为正极,正极氢离子放电生成氢气,以此解答该题.
解答:
解:A.图①中正极发生:Cu2++2e-=Cu,如不考虑盐类水解,则正极pH不变,如考虑盐类水解,则正极pH增大,故A错误;
B.原电池中阴离子向负极移动,即向硫酸锌溶液移动,故B错误;
C.图②铁为负极,铜为正极,正极氢离子放电生成氢气,电极方程式为2H++2e-=H2↑,故C错误;
D.图②中生成Fe2+,亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,故D正确.
故选D.
B.原电池中阴离子向负极移动,即向硫酸锌溶液移动,故B错误;
C.图②铁为负极,铜为正极,正极氢离子放电生成氢气,电极方程式为2H++2e-=H2↑,故C错误;
D.图②中生成Fe2+,亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,故D正确.
故选D.
点评:本题综合考查原电池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该类题目的关键,难度中等.

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、过量氯气通入溴化亚铁溶液中:2Cl2+2Fe2++2Br-═4Cl-+2Fe3++Br2 |
B、向苯酚溶液中滴加Na2CO3溶液: +CO32-→ +CO32-→ +CO2↑+H2O +CO2↑+H2O |
| C、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
| D、用过量的冷氨水吸收SO2:SO2+2NH3?H2O═SO32-+2NH4++H2O |
十八大报告中提出“大力推进生态文明建设,提高生态文明水平,建设美丽中国”.化学已渗透到人类生活的各个方面.下列说法正确的是( )
| A、PM2.5是指大气中直径≤2.5微米的颗粒物,只要戴普通口罩就对人体健康无影响 |
| B、乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
| C、绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的化合物 |
| D、制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
化学与人类生产、生活、社会可持续发展密切相关.下列有关说法错误的是( )
| A、煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 |
| B、在汽车排气管上加装“催化转化器”是为了减少有害气体的排放 |
| C、硬铝属于合金材料,瓷器属于硅酸盐制品 |
| D、食醋可去除水垢,NH4Cl溶液可去除铁锈 |
下列说法正确的是( )
| A、蛋白质及其水解产物都具有两性 |
| B、淀粉和油脂都是可水解的高分子化合物 |
| C、鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
| D、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
芳香化合物M的结构简式为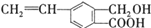 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )
 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )| A、有机物M的分子式为C10H12O3 |
| B、1mol Na2CO3最多能消耗1mol有机物M |
| C、1mol M和足量金属钠反应生成22.4L气体 |
| D、有机物M能发生取代、氧化和加成反应 |