题目内容
A、B、C均为短周期元素,可形成A2C和BC2两种化合物.A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个.它们的元素符号分别为:A ;B ;C ;B原子的结构示意图为 ;BC2是由 键组成的 (填“极性”或“非极性”)分子.
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A原子的K层的电子数目只有一个,则A为H元素;
B位于A的下一周期,它的最外层电子数比K层多2,则B位于第二周期,最外层含有4个电子,则B为C元素;
C原子核外的最外层电子数比次外层电子数少2个,最外层电子数为:8-2=6,且为短周期元素,则C为S元素,
根据分析可知,A为H元素、B为C元素、C为S元素,据此进行解答.
B位于A的下一周期,它的最外层电子数比K层多2,则B位于第二周期,最外层含有4个电子,则B为C元素;
C原子核外的最外层电子数比次外层电子数少2个,最外层电子数为:8-2=6,且为短周期元素,则C为S元素,
根据分析可知,A为H元素、B为C元素、C为S元素,据此进行解答.
解答:
解:A原子的K层的电子数目只有一个,则A为H元素;B位于A的下一周期,它的最外层电子数比K层多2,则B位于第二周期,最外层含有4个电子,则B为C元素; C原子核外的最外层电子数比次外层电子数少2个,且为短周期元素,则C为S元素,
根据分析可知:A为H元素、B为C元素、C为S元素;
B为C元素,碳原子的核电荷数=核外电子总数=6,其原子结构示意图为: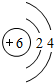 ;
;
BC2为二硫化碳,二硫化碳与二氧化碳结构相似,为直线型结构,则二硫化碳为极性键形成的非极性分子,
故答案为:H;C;S;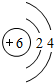 ;极性;非极性.
;极性;非极性.
根据分析可知:A为H元素、B为C元素、C为S元素;
B为C元素,碳原子的核电荷数=核外电子总数=6,其原子结构示意图为:
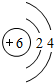 ;
;BC2为二硫化碳,二硫化碳与二氧化碳结构相似,为直线型结构,则二硫化碳为极性键形成的非极性分子,
故答案为:H;C;S;
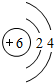 ;极性;非极性.
;极性;非极性.
点评:本题考查了位置、结构与性质的关系,题目难度不大,试题侧重 基础知识的考查,正确推断各元素名称为解答关键,注意明确原子结构与元素周期表、元素周期律的关系.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
“稀土”是我国宝贵的战略资源,国家即将控制其出口.
Sm 与
Sm是稀土元素,下列有关说法不正确的是( )
144 62 |
150 62 |
A、
| ||||
B、
| ||||
C、
| ||||
D、据
|
某溶液100mL,其中c(H2SO4)为0.3 mol/L,c(HNO3)为0.4 mol/L,若在该溶液中投入1.92g铜粉微热,充分反应后,所得溶液中Cu2+的物质的量浓度为(假设反应前后溶液的体积不变)( )
| A、0.15mol/L |
| B、0.2mol/L |
| C、0.3mol/L |
| D、0.4mol/L |
将过量的CO2分别通入下列溶液中,最终有沉淀析出的是( )
| A、CaCl2溶液 |
| B、饱和Na2CO3溶液 |
| C、Ca(ClO)2溶液 |
| D、Ca(OH)2溶液 |
在150℃时,将某气态烃和氧气混合气体点燃,恢复到原来的温度和压强,发现反应前后气体的体积不变,试推断该烃的分子式可能是( )
| A、乙烷 | B、乙烯 | C、丁烷 | D、苯 |
 生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
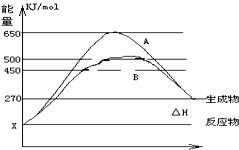 (1)已知:Fe(s)+
(1)已知:Fe(s)+