题目内容
2.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢.(1)A的结构简式为
 ;
;(2)A中肯定共面的碳原子数有6个,A中最多10个原子共面.
(3)若0.5mol的烃A完全燃烧后,燃烧时消耗标准状况下的氧气100.8L.
(4)烃A的一种同分异构体不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为
 .
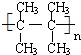
.(5)烃A在催化剂加热条件下发生加聚反应,化学方程式为n (CH3)2C=C(CH3)2$\stackrel{催化剂}{→}$
 在催化剂作用下,与H2加成后的产物名称为2,3-二甲基丁烷.
在催化剂作用下,与H2加成后的产物名称为2,3-二甲基丁烷.
分析 某烃类化合物A的质谱图表明其相对分子质量为84,令组成为CxHy,则x最大值为$\frac{84}{12}$=7,红外光谱表明分子中含有碳碳双键,所以A为烯烃,所以x=6,y=12,因此A的化学式为C6H12,核磁共振氢谱表明分子中只有一种类型的氢,故A的结构简式为: .(4)中烃A的一种同分异构体不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A为环己烷.
.(4)中烃A的一种同分异构体不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A为环己烷.
解答 解:(1)某烃类化合物A的质谱图表明其相对分子质量为84,令组成为CxHy,则x最大值为$\frac{84}{12}$=7,红外光谱表明分子中含有碳碳双键,所以A为烯烃,所以x=6,y=12,因此A的化学式为C6H12,核磁共振氢谱表明分子中只有一种类型的氢,故A的结构简式为: ,
,
故答案为: ;
;
(2) 中含有C=C双键的平面结构,4个甲基的C原子处于C=C双键的平面结构内,分子碳原子都处于同一平面,故A中肯定共面的碳原子数有6个,旋转碳碳单键可以使甲基中1个H原子处于碳碳双键平面内,A中最多10个原子共面,
中含有C=C双键的平面结构,4个甲基的C原子处于C=C双键的平面结构内,分子碳原子都处于同一平面,故A中肯定共面的碳原子数有6个,旋转碳碳单键可以使甲基中1个H原子处于碳碳双键平面内,A中最多10个原子共面,
故答案为:6;10;
(3)若0.5mol的烃A完全燃烧后,燃烧时消耗氧气为0.5mol×(6+$\frac{12}{4}$)=4.5mol,消耗标准状况下的氧气体积为4.5mol×22.4L/mol=100.8L,
故答案为:100.8;
(4)中烃A的一种同分异构体不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A为环己烷,结构简式为 ,
,
故答案为: ;
;
(5)烃A在催化剂加热条件下发生加聚反应,化学方程式为:n (CH3)2C=C(CH3)2$\stackrel{催化剂}{→}$ ,
,
在催化剂作用下,A与H2加成后的产物为(CH3)2CHCH(CH3)2,名称是2,3-二甲基丁烷,
故答案为:n (CH3)2C=C(CH3)2$\stackrel{催化剂}{→}$ ;2,3-二甲基丁烷.
;2,3-二甲基丁烷.
点评 本题考查有机物分子式与结构的确定、有机物结构与性质、有机物燃烧计算等,理解掌握相对分子质量商余法确定氢的分子式.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案| A. | SO2通入盐酸酸化的硝酸钡溶液 | B. | 在AlCl3溶液中滴入过量的氨水 | ||
| C. | 在空气中长期存放的漂白粉溶液 | D. | 将少量NaAlO2投入盐酸中 |
实验名称:卤素单质的氧化性强弱比较
| 实验步骤 | 实验结论 |
| ①氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 |
(1)完成该实验需用到的实验仪器是试管、胶头滴管.
(2)②中反应的化学方程式为2NaBr+Cl2=2NaCl+Br2.③中反应的离子方程式为2I-+Cl2=2Cl-+I2.
(3)CCl4在实验中所起的作用是萃取剂.
(4)该同学的实验设计不足之是没有比较Br2和I2的氧化性强弱,改进的办法是把第③步改为:将溴水滴在KI淀粉试纸上,观察试纸是否变蓝色(或KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色).(填相应的实验步骤)
| A. | 四氯化碳分子的电子式为: | |
| B. | C1-的结构示意图: | |
| C. | 醋酸的电离方程式:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 聚丙烯的结构简式: |
| A. | 产生气体的质量为0.3g | |
| B. | 合金中镁与铝的物质的量之比为1:2 | |
| C. | 溶液X中剩余NaOH的物质的量为0.2 mol | |
| D. | 向溶液X中通入足量C02,过滤,将沉淀充分灼烧得固体15.6 g |
| A. | ${\;}_{8}^{16}$O | B. |  | C. | 1s22s22p4 | D. |  |
| A. | c(NH4+)相等的NH4HCO3溶液、(NH4)2Fe(SO4)2溶液和(NH4)2SO4溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4HCO3) | |
| B. | 常温下,0.1 mol•L-1HCl溶液与等体积0.1 mol•L-1Ba(OH)2溶液混合后,溶液的pH=13 | |
| C. | 常温下,由水电离产生的c(H+)=10-13 mol•L-1的溶液,Fe2+、NO3-、Cl-、SO42-一定不能大量共存 | |
| D. | 0.1 mol•L-1的NaHCO3溶液中,c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |


 .
. .
. ,反应类型是加成反应.
,反应类型是加成反应.