题目内容
15.多硫化钠Na 2S x(x≥2)在NaOH溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16.Na2Sx在结构上与Na2Sx类似.则下列有关说法正确的是( )| A. | 该反应中Na2Sx是氧化剂,NaClO是还原剂 | |
| B. | Na2Sx含有离子键和极性共价键 | |
| C. | 1molNa2Sx参加反应,有32mol电子转移 | |
| D. | Na2Sx中的X数值为2 |
分析 Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,S元素的化合价由-$\frac{2}{x}$价变为+6价,NaClO被还原成NaCl,Cl元素的化合价由+1价变为-1价,根据得失电子守恒得,
设Na2Sx的物质的量是1mol,则次氯酸钠的物质的量是16mol,由电子守恒可计算x,以此来解答.
解答 解:A.S元素的化合价升高,Cl元素的化合价降低,则该反应中Na2Sx是还原剂,NaClO是氧化剂,故A错误;
B.Na2Sx含有离子键和S-S非极性共价键,故B错误;
C.则1molNa2Sx参加反应,则16molNaClO反应,有16mol×[1-(-1)]=32mol电子转移,故C正确;
D.设Na2Sx的物质的量是1mol,则次氯酸钠的物质的量是16mol,由电子守恒可计算x,1mol×[6-(-$\frac{2}{x}$)]x=16mol×[1-(-1)],解得x=5,故D错误;
故选C.
点评 本题以物质间的计算为载体考查了氧化还原反应,明确元素化合价是解本题关键,结合电子守恒解答即可,题目难度不大.

练习册系列答案
相关题目
6.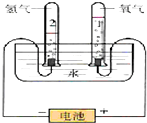 水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图.
水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图.
(1)写出电解水的化学方程式,若为氧化还原反应,请用双线桥表示出电子的转移方向和数目.
 .
.
(2)假设电解了3.6gH2O,请完成下表.
(3)若在47.8gH2O(过量)中加入2.3gNa.钠与水反应的离子方程式为2Na+2 H2O═2Na++2OH-+H2↑,,反应后得到的溶液中溶质是NaOH,溶质的质量分数为8%,若要计算该溶液中溶质的物质的量浓度,则还需要溶液密度(填物理量).
(4)若在电解水后收集到O2体积为22.4mL(在标准状况下),则收集到的H2的质量0.004g.
 水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图.
水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图.(1)写出电解水的化学方程式,若为氧化还原反应,请用双线桥表示出电子的转移方向和数目.
 .
.(2)假设电解了3.6gH2O,请完成下表.
| 质 量 | 物质的量 | O2与H2的体积比(同温同压下) | |
| O2 | 3.2g | 0.1mol | 1:2 |
| H2 | 0.4g | 0.2mol |
(4)若在电解水后收集到O2体积为22.4mL(在标准状况下),则收集到的H2的质量0.004g.
3.全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:V3++VO2++H2O VO2++2H++V2+..下列说法正确的是( )
VO2++2H++V2+..下列说法正确的是( )
 VO2++2H++V2+..下列说法正确的是( )
VO2++2H++V2+..下列说法正确的是( )| A. | 放电时正极反应为:VO${\;}_{2}^{+}$+2H++e-═VO2++H2O | |
| B. | 充电过程中,H+由阴极区向阳极区迁移 | |
| C. | 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 | |
| D. | 充电时阴极反应为:V2+-e-═V3+ |
20.0.02mol•L-1的HCN溶液与0.02mol•L-1 NaCN溶液等体积混合,已知混合溶液中c(CN-)<c(Na+),则下列关系中,正确的是( )
| A. | c(Na+)>c(CN-)>c(H+)>c(OH-) | B. | c(HCN)+c(CN-)═0.04 mol•L-1 | ||
| C. | c(Na+)+c(H+)═c(CN-)+c(OH-) | D. | c(CN-)<c(HCN) |
7.化学家制造出一种物质“干水”,其每个颗粒含水95%,外层是沙质硅,干水吸收CO2的能力比普通水高三倍.下列说法正确的是( )
| A. | 干水是纯净物 | B. | 干水和干冰是同一种物质 | ||
| C. | 干水中的水分子不再运动 | D. | 用干水能更好地吸收CO2 |
4.关于酸和碱的下列叙述,正确的是( )
| A. | 凡是组成中含有氢元素的化合物都属于酸 | |
| B. | 凡是组成中含有OH-的化合物都属于碱 | |
| C. | 酸和碱中至少含有一种相同的元素 | |
| D. | 酸和碱中都含有金属阳离子和阴离子 |
 c”或“d”)
c”或“d”)
 以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。