题目内容
核电荷数均小于18的A、B、C、D四种元素,它们的原子序数依次增大.A、B两元素位于同一周期,A元素原子的电子式为
;B元素原子的L层电子数是K层的3倍;C的单质常温下在空气中能形成致密的氧化膜,将C的单质放入氢氧化钠溶液中有气体生成;D与C同周期,且D的化合物在海水中含量最高. 请回答下列问题:
(1)写出下列元素的名称:A ,B ,C ,D .
(2)B元素在周期表中的位置为 .
(3)由元素A与D形成的简单化合物的电子式为 .
(4)C与D反应所得的产物与过量NaOH溶液反应的离子方程式为 .
? ? |
| A | ? ? |
(1)写出下列元素的名称:A
(2)B元素在周期表中的位置为
(3)由元素A与D形成的简单化合物的电子式为
(4)C与D反应所得的产物与过量NaOH溶液反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:核电荷数均小于18的A、B、C、D四种元素,它们的原子序数依次增大;B元素原子的L层电子数是K层的3倍,则L层含有6个电子,则B为O元素;A、B两元素位于同一周期,A元素原子的电子式为
,则A为C元素;C的单质常温下在空气中能形成致密的氧化膜,将C的单质放入氢氧化钠溶液中有气体生成,则C为Al元素;D与C同周期,且D的化合物在海水中含量最高,海水中含量最高的为NaCl,结合原子序数大小可知D为Cl元素,据此进行解答.
? ? |
| A | ? ? |
解答:
解:(1)核电荷数均小于18的A、B、C、D四种元素,它们的原子序数依次增大;B元素原子的L层电子数是K层的3倍,则L层含有6个电子,则B为O元素;A、B两元素位于同一周期,A元素原子的电子式为
,则A为C元素;C的单质常温下在空气中能形成致密的氧化膜,将C的单质放入氢氧化钠溶液中有气体生成,则C为Al元素;D与C同周期,且D的化合物在海水中含量最高,海水中含量最高的为NaCl,结合原子序数大小可知D为Cl元素,
根据以上分析可知,A、B、C、D元素的名称依次为:碳、氧、铝、氯,故答案为:碳;氧;铝;氯;
(2)B为O元素,其原子序数为8,位于周期表中第二周期ⅥA族,故答案为:第二周期ⅥA族;
(3)由元素A与D形成的简单化合物为四氯化碳,四氯化碳为共价化合物,其电子式为: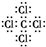 ,故答案为:
,故答案为: ;
;
(4)C与D反应所得的产物为氯化铝,氯化铝与过量NaOH溶液反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
? ? |
| A | ? ? |
根据以上分析可知,A、B、C、D元素的名称依次为:碳、氧、铝、氯,故答案为:碳;氧;铝;氯;
(2)B为O元素,其原子序数为8,位于周期表中第二周期ⅥA族,故答案为:第二周期ⅥA族;
(3)由元素A与D形成的简单化合物为四氯化碳,四氯化碳为共价化合物,其电子式为:
 ,故答案为:
,故答案为: ;
;(4)C与D反应所得的产物为氯化铝,氯化铝与过量NaOH溶液反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
点评:本题考查了位置、结构与性质关系的应用,题目难度中等,正确推断各元素名称为解答关键,试题侧重考查常见化学用语的表示方法,注意掌握原子结构与元素周期表、元素周期律的关系.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
下列化学用语或模型表达正确的是( )
A、8个中子的碳原子的核素符号:
| ||
B、H2O的电子式: | ||
C、Cl-的结构示意图: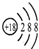 | ||
D、CH4分子的比例模型: |
下列各原子构成的单质,肯定能与稀硫酸反应产生H2的是( )
| A、原子核内没有中子 |
| B、M层有5个电子 |
| C、原子核外最外层电子数=电子层数 |
| D、N层上电子数与K层电子数相等,次外层有8个电子 |
在一个不传热的固定容积的密闭容器中,可逆反应:N2+3H2═2NH3,达到平衡的标志是( )
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥2V(N2)正=V(NH3)逆
⑦单位时间内3mol H-H断键反应同时2mol N-H也断键反应.
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥2V(N2)正=V(NH3)逆
⑦单位时间内3mol H-H断键反应同时2mol N-H也断键反应.
| A、①、②、③、⑤、⑥ |
| B、②、③、⑤、⑥ |
| C、②、③、⑤、⑥、⑦ |
| D、②、③、④、⑥、⑦ |


 常用于制备药物和合成高分子材料.(1)化合物Ⅰ的分子式为
常用于制备药物和合成高分子材料.(1)化合物Ⅰ的分子式为
 +CH3COOH→
+CH3COOH→ .聚合物可用于制备
.聚合物可用于制备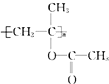



 下表中各组物质之间不能通过一步反应实现如图的是( )
下表中各组物质之间不能通过一步反应实现如图的是( )  液反应生成盐;丙、戊可组成化合物M.
液反应生成盐;丙、戊可组成化合物M.