题目内容
比较下列各组热化学方程式中△H的大小关系,(填“>”、“<”或“=”).
(1)S(s)+O2(g)═SO2(g)△H1
S(g)+O2(g)═SO2(g)△H2
△H1 △H2
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
△H1 △H2
(3)煤作为燃料有两种途径:
途径1--直接燃烧 C(s)+O2(g)═CO2(g)△H1<0
途径2--先制水煤气 C(s)+H2O(g)═CO(g)+H2(g)△H2>0
再燃烧水煤气 2CO(g)+O2(g)═2CO2(g)△H3<0
2H2(g)+O2(g)═2H2O(g)△H4<0
△H1、△H2、△H3、△H4之间的关系式是 .
(1)S(s)+O2(g)═SO2(g)△H1
S(g)+O2(g)═SO2(g)△H2
△H1
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
△H1
(3)煤作为燃料有两种途径:
途径1--直接燃烧 C(s)+O2(g)═CO2(g)△H1<0
途径2--先制水煤气 C(s)+H2O(g)═CO(g)+H2(g)△H2>0
再燃烧水煤气 2CO(g)+O2(g)═2CO2(g)△H3<0
2H2(g)+O2(g)═2H2O(g)△H4<0
△H1、△H2、△H3、△H4之间的关系式是
考点:反应热的大小比较,用盖斯定律进行有关反应热的计算
专题:
分析:(1)固体硫燃烧时要先变为气态硫,过程吸热;
(2)水由气态变成液态,放出热量;
(3)由盖斯定律,将途径Ⅱ的三个化学方程式乘以适当的系数进行加减,反应热也乘以相应的系数进行相应的加减,构造出途径I的热化学方程式,据此判断△H1、△H2、△H3、△H4的数学关系式.
(2)水由气态变成液态,放出热量;
(3)由盖斯定律,将途径Ⅱ的三个化学方程式乘以适当的系数进行加减,反应热也乘以相应的系数进行相应的加减,构造出途径I的热化学方程式,据此判断△H1、△H2、△H3、△H4的数学关系式.
解答:
解:(1)固体硫燃烧时要先变为气态硫,过程吸热,气体与气体反应生成气体比固体和气体反应生成气体产生热量多,但反应热为负值,所以△H1>△H2;
故答案为:>;
(2)水由气态变成液态,放出热量,所以生成液态水放出的热量多,但反应热为负值,所以△H1<△H2;
故答案为:<;
(3)途径Ⅱ:C(s)+H2O(g)═CO(g)+H2(g)△H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0 ③
2H2(g)+O2 (g)═2H2O(g)△H4<0 ④
由盖斯定律可知,②×2+③+④得2C(s)+2O2 (g)═2CO2(g)△H=2△H2+△H3+△H4.
所以△H1=
△H=
(2△H2+△H3+△H4)=△H2+
(△H3+△H4),
故答案为:△H2+
(△H3+△H4).
故答案为:>;
(2)水由气态变成液态,放出热量,所以生成液态水放出的热量多,但反应热为负值,所以△H1<△H2;
故答案为:<;
(3)途径Ⅱ:C(s)+H2O(g)═CO(g)+H2(g)△H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0 ③
2H2(g)+O2 (g)═2H2O(g)△H4<0 ④
由盖斯定律可知,②×2+③+④得2C(s)+2O2 (g)═2CO2(g)△H=2△H2+△H3+△H4.
所以△H1=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:△H2+
| 1 |
| 2 |
点评:本题考查反应中热量大小比较,难度中等,注意盖斯定律的利用,物质的聚集状态不同,反应放出或吸收的热量是不同的

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关烃的叙述正确的是( )
| A、戊烷分子中的五个碳原子可以处在同一条直线上 |
| B、C4H6分子中的四个碳原子不可能处在同一条直线上 |
| C、C6H12分子中六个碳原子不可能处于同一平面上 |
D、 分子中至少有10个碳原子处于同一平面上 分子中至少有10个碳原子处于同一平面上 |
500K时,有CO催化剂加氢反应:CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0,下列有关说法正确的是( )
| A、温度升高时,该反应的平衡常数K增大 |
| B、缩小容器体积,平衡体系中各物质的浓度均增大 |
| C、温度越低,越有有利于CO催化氢 |
| D、从平衡体系中分离出H2O(g)能加快正反应速率 |
反应A2(g)+3B2(g)?4C2(g)+2D2(g)在5L密闭容器中进行,半分钟后,C2的物质的量增加了0.3mol,则此反应的平均速率
(x)( )
. |
| v |
A、
| ||
B、
| ||
C、
| ||
D、
|
实验表明,在一定条件下,乙烯和水反应可表示为:C2H4(g)+H2O(g)═C2H5OH(g)△H=-45.8kJ/mol
则下列说法中正确的是( )
则下列说法中正确的是( )
| A、实验中,乙烯的用量不会影响该反应的反应焓变△H |
| B、0.5molH2O(l)完全反应放出的热量为22.9kJ |
| C、1molC2H5OH(g)具有的能量大于1molC2H4(g)和1molH2O(g)所具有的能量和 |
| D、1molC2H4(g)和1molH2O (g)中化学键的总键能大于1molC2H5OH(g)中化学键的总键能 |
已知298K时,2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1;向另一体积相同的密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2.则下列关系式正确的是( )
| A、2Q2=Q1 | ||
| B、2Q2<Q1 | ||
| C、Q2<Q1=197kJ | ||
D、Q2=
|
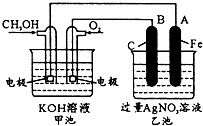 如图是一个化学过程的示意图.已知甲池的总反应式为:
如图是一个化学过程的示意图.已知甲池的总反应式为: