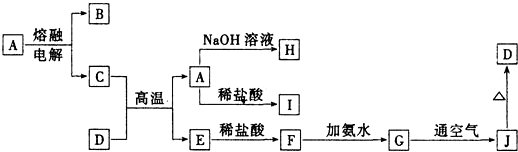
题目内容
14.查阅资料知:Br2的沸点为59℃,微溶于水,有毒性.某化学小组模拟工业流程从浓缩的海水中提取液溴,主要实验装置(夹持装置略去)及操作步骤如下: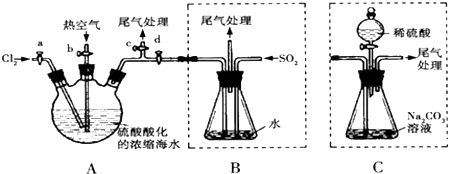
①连接A与B,关闭活塞b、d,打开活塞a、c,向三颈瓶A中缓慢通Cl2至反应完全;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2,完全反应;
⑤将B中所得液体进行蒸馏,收集液溴.
请回答:
(1)可以判断步骤①中反应已经完全的现象是容器A中液面上有黄绿色气体出现.
(2)步骤②中鼓入热空气的作用为吹出反应中生成的Br2.
(3)步骤③中B容器里反应的化学方程式为Br2+SO2+H2O═2HBr+H2SO4.
(4)本实验多次涉及尾气处理,可吸收处理B中尾气的是C(填选项).
A.浓硫酸 B.饱和NaCl溶液 C.NaOH溶液 D.水
(5)用C代替B,进行步骤①和②,此时C中有NaBr、NaBrO3等物质生成,该反应的化学方程式为3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑.
(6)继续向锥形瓶中滴加稀硫酸,经步骤⑤,也能制得液溴.与B装置相比,采用C装置的优点为无污染,操作简便.
分析 A中海水用硫酸酸化,通入热空气和氯气,发生氧化还原反应生成溴,空气将溴吹出,通入二氧化硫,发生Br2+SO2+H2O═2HBr+H2SO4,富集后再通入氯气,生成溴,可用氢氧化钠溶液吸收尾气,
(1)氯气为黄绿色气体,反应完毕应剩余氯气;
(2)溴易挥发,鼓入空气可将溴排出;
(3)溴与二氧化硫发生氧化还原反应;
(4)溴、氯气和二氧化硫都有毒,可用碱液吸收;
(5)溴和碳酸钠反应生成了溴化钠和溴酸钠,结合质量守恒配平方程式;
(6)采用C装置,步骤少,减少了二氧化硫的污染.
解答 解:A中海水用硫酸酸化,通入热空气和氯气,发生氧化还原反应生成溴,空气将溴吹出,通入二氧化硫,发生Br2+SO2+H2O═2HBr+H2SO4,富集后再通入氯气,生成溴,可用氢氧化钠溶液吸收尾气,
(1)氯气为黄绿色气体,反应完毕应剩余氯气,容器A中液面上有黄绿色气体出现,故答案为:容器A中液面上有黄绿色气体出现;
(2)溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,故答案为:吹出反应中生成的Br2;
(3)溴与二氧化硫发生氧化还原反应,反应的化学方程式为Br2+SO2+H2O═2HBr+H2SO4,故答案为:Br2+SO2+H2O═2HBr+H2SO4;
(4)氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以用碱液吸收,
故答案为:C;
(5)溴和碳酸钠反应生成了溴化钠和溴酸钠,反应的方程式为3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,故答案为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑;
(6)采用C装置,步骤少,减少了二氧化硫的污染,故答案为:无污染,操作简便.
点评 本题结合海水提取溴的过程,为高频考点,侧重于学生的分析、实验能力的考查,题目注重考查了实验基本操作、实验方案的评价、氧化还原反应方程式的书写,题目难度中等.

 名校课堂系列答案
名校课堂系列答案①CO、O2(2:1)②NH3、O2(8:1)③NO2、O2(4:1)④N2、H2(1:3)
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol?1,下列判断正确的是ad.
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)?C(s)+H2O(1)△H=-QkJ•mol?1,则Q<131.4
d.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol?1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
①0min~2min 内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad.(填字母)
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过).

①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为4H++O2+4e-=2H2O.
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 用黏土烧制陶瓷 | D. | 打磨磁石制指南针 |
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将Na块投入水中,产生气体:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 0.1 mol•L-1亚硫酸氢钠溶液的pH约为3:HSO3-+H2O═SO32-+H3O+ | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 定容后,塞好瓶塞,反复倒转、摇匀 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解 |
| 元素 | 相关信息 |
| X | X是形成化合物类最多,它一气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成一化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气来源 |
| V | V的单质是淡黄色固体,是黑火药一主要成分 |
| W | 日常生活中应用最广泛的金属之一,且W有几种不同价态的氧化物,其中一种有磁性 |
(2)Y、Z、V对应简单离子半径由大到小的顺序为S2->O2->Na+.(书写离子符号),写出Z2Y2与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(3)X和V形成的化合物是一种无色液体,其合成方法之一是一定条件下用含氢质量分数最大的有机物和V的单质为原料,同时生成一种臭鸡蛋气味的气体.请写出化学反应方程式:
(4)已知W2Y3(s)+3XY(g)=2W(s)+3XY2(g)△H=-26.7kJ•mol-1
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g)△H=-50.75kJ•mol-1
W3Y4(s)+XY(g)=3WY(s)十XY2(g)△H=-36.5kJ•mol-1
则相同,反应WY(s)+XY(g)=W(s)+XY2(g)△H=+7.3 kJ•mol-1.