题目内容
5.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 标况下,22.4L的Cl2与足量水反应中电子转移了2NA | |
| B. | 0.1mol/LK2SO4溶液中含有0.2NA个阳离子 | |
| C. | 常温常压下,22.4LO2气体的分子数小于NA | |
| D. | 20g D2O所含的中子数为9NA |
分析 A.氯气与水反应为可逆反应且为歧化反应;
B.溶液体积未知;
C.标况下Vm>22.4L/mol;
D.1个D2O含有10个中子.
解答 解:A.氯气与水反应为可逆反应且为歧化反应,所以标况下,22.4L的Cl2与足量水反应中电子数小于NA,故A错误;
B.溶液体积未知,无法计算1mol/LK2SO4溶液中含有阳离子个数,故B错误;
C.标况下Vm>22.4L/mol,常温常压下,22.4LO2气体物质的量小于1mol,分子数小于NA,故C正确;
D.20g D2O所含的中子数为$\frac{20g}{20g/mol}$×10×NA=10NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积使用条件和对象.

练习册系列答案
相关题目
15.下列为检验碳酸氢钠固体中是否含有碳酸钠而进行的实验中正确的是( )
| A. | 加热,观察是否有气体放出 | |
| B. | 取少量固体配成稀溶液,滴加石灰水,观察有无沉淀生成 | |
| C. | 取少量固体配成稀溶液,滴加氯化钡溶液,观察有无沉淀生成 | |
| D. | 加热前后称量固体,比较固体质量是否变化 |
16.25℃时,相同物质的量浓度的下列溶液:①NaCl ②NaOH ③H2SO4其中水的电离程度按由大到小顺序排列的一组是( )
| A. | ③>②>① | B. | ②>③>① | C. | ①>②>③ | D. | ③>①>② |
13.下列说法正确的是( )
| A. | ${\;}_{17}^{37}$Cl表示质子数为17、中子数为20的核素 | |
| B. | 乙二醇(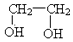 )和甘油( )和甘油(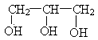 )互为同系物 )互为同系物 | |
| C. | 干冰和CO2互为同分异构体 | |
| D. | 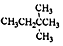 的名称是3,3-二甲基丁烷 的名称是3,3-二甲基丁烷 |
20.已知氧化性Fe3+>I2,在含有nmolFeI2的溶液中通入Cl2,有x mol Cl2发生反应.下列说法正确的是( )
| A. | 当x≤n时,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 当x≥$\frac{3n}{2}$时,反应的离子方程式为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 当n≤x≤$\frac{3n}{2}$时,反应中转移电子的物质的量n(e-)为2nmol≤n(e-)≤3nmol | |
| D. | 当n<x<$\frac{3n}{2}$时,溶液中Fe3+、Cl-、I2的物质的量之比为2(x-n):x:n |
10.室温下,0.1mol/LNaClO溶液的pH大于0.1mol/LNa2SO3溶液的pH.(选填“大于”、“小于”,或“等于”).浓度均为0.1mol/L的Na2SO3和Na2SO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为.已知:
| Na2SO3 | Kal=1.54×l0-2 | Ka2=1.02×10-7 |
| HCIO | Ka1=2.95×10-8 | |
| H2CO3 | Kal=4.3×10-7 | Ka2=5.6×10-11 |
17.下列说法正确的是( )
| A. | 石油的分馏和裂化均属于化学变化 | |
| B. | 花生油、石油、羊油和牛油均属于高级脂肪酸甘油酯 | |
| C. | 煤在空气中经过高温强热制得焦炭、苯等化工原料 | |
| D. | 汽油、柴油通常作为汽车的燃料,是一种清洁的燃料 |
16.化学中有很多有趣的现象和规律,它可以借助于数学工具来描述.符合表分子式的分子本身或其某种同分异构体,仅有一种一氯代物,请判断第7项的分子式( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H6 | C5H12 | C8H18 |
| A. | C13H28 | B. | C17H36 | C. | C26H54 | D. | C53H108 |