题目内容
16.化学中有很多有趣的现象和规律,它可以借助于数学工具来描述.符合表分子式的分子本身或其某种同分异构体,仅有一种一氯代物,请判断第7项的分子式( )| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H6 | C5H12 | C8H18 |
| A. | C13H28 | B. | C17H36 | C. | C26H54 | D. | C53H108 |
分析 分子式的分子本身或其某种同分异构体,仅有一种一氯代物,说明分子中仅含有1种H原子,则分子中仅含有甲基,可用甲基分别取代甲烷或乙烷的H原子,以此解答该题.
解答 解:由表中数据可知3、5、7应用甲基分别取代甲烷的H原子,2、4、6用甲基分别取代乙烷的H原子,则第5项为C17H36,第7项为36个甲基取代中C17H36的H,应含53个C,则分子式为C53H108,
故选D.
点评 本题考查同分异构体的书写,为高频考点,侧重考查学生的分析能力、归纳与整理的能力,题目难度中等,注意对比化学式发现物质组成所存在的规律是关键,易错点是等效氢的判断方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标况下,22.4L的Cl2与足量水反应中电子转移了2NA | |
| B. | 0.1mol/LK2SO4溶液中含有0.2NA个阳离子 | |
| C. | 常温常压下,22.4LO2气体的分子数小于NA | |
| D. | 20g D2O所含的中子数为9NA |
7.下列说法正确的是( )
| A. | 某试样焰色反应呈黄色,则试样中肯定不含有K+ | |
| B. | 过滤操作时,为了加快过滤可以用玻璃棒搅拌漏斗的液体 | |
| C. | 蒸馏装置中,温度计水银球的位置应该在蒸馏烧瓶的支管口附近 | |
| D. | 粗盐的提纯实验中,滤液在坩埚中加热蒸发结晶 |
4.某酸性工厂废水中含有浓度约为0.01mol•L-1的Ag+、Pb2+等重金属离子,已知:Ksp(AgOH)=5.6×10-8;Ksp[Pb(OH)2]=1.2×10-15;某工程师用CaO处理上述废水,最终溶液的pH=8,处理后废水中c(Pb2+)是( )
| A. | 1.2×10-3mol•L-1 | B. | 1.2×10-9mol•L-1 | C. | 2.4×10-5mol•L-1 | D. | 3.2×10-6mol•L-1 |
11.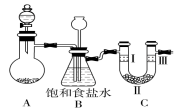 某学习小组围绕氯气设计了一系列实验.
某学习小组围绕氯气设计了一系列实验.
(1)用如图装置A制备氯气.选用的药品为漂粉精固体和浓盐酸,相关的化学方程式为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除氯气中的氯化氢;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗下端导管中液面会上升,形成水柱.
(3)为检验氯气是否具有漂白性,使氯气依次通过Ⅰ、Ⅱ、Ⅲ三种物质,物质的顺序正确的是D.
(4)为了进一步比较氧化性强弱,将一定量氯气通入溴化亚铁溶液后,再加入四氯化碳,振荡,静置,整个过程中肯定能观察到的现象是A.
A.水层显棕黄色 B.水层无色C.四氯化碳层显红棕色 D.四氯化碳层无色
(5)查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质.
(6)有人提出,工业上为防止污染空气,可用足量的Na2SO3溶液吸收余氯,试写出相应的离子方程式:Cl2+SO32-+H2O=SO42-+2H++Cl-.判断改用NaHSO3溶液是否可行:否(填“是”或“否”).
 某学习小组围绕氯气设计了一系列实验.
某学习小组围绕氯气设计了一系列实验.(1)用如图装置A制备氯气.选用的药品为漂粉精固体和浓盐酸,相关的化学方程式为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除氯气中的氯化氢;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗下端导管中液面会上升,形成水柱.
(3)为检验氯气是否具有漂白性,使氯气依次通过Ⅰ、Ⅱ、Ⅲ三种物质,物质的顺序正确的是D.
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
A.水层显棕黄色 B.水层无色C.四氯化碳层显红棕色 D.四氯化碳层无色
(5)查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质.
(6)有人提出,工业上为防止污染空气,可用足量的Na2SO3溶液吸收余氯,试写出相应的离子方程式:Cl2+SO32-+H2O=SO42-+2H++Cl-.判断改用NaHSO3溶液是否可行:否(填“是”或“否”).
1.下列气体可用排水法收集的是( )
| A. | NH3 | B. | SO2 | C. | NO2 | D. | CH4 |
8.下列生活中的常见现象不涉及化学变化的是( )
| A. | 古铜币上出现铜绿【Cu2(OH)2CO3】 | B. | 铝制用品表面变暗 | ||
| C. | 钢铁生锈 | D. | 粗盐潮解 |
5.现有反应4NH3+5O2=4NO+6H2O,反应速率分别用v (NH3)、v (O2)、v (NO)、v (H2O)、表示,其关系正确的是( )
| A. | 4v (NH3)=5(O2) | B. | 4 v(NH3)=5 v(H2O) | C. | 4(O2)=5 v(NO) | D. | 4 v(NH3)=5 v(NO) |
6.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的己烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1mol羟基所含电子数为7 NA | |
| D. | 现有乙烯、丙烯的混合气体共14g,其原子数为3 NA |