题目内容
过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、鱼池增氧等.过氧化钙在常温下是白色或淡黄色粉末,易溶于酸,难溶于水、乙醇等溶剂.某实验小组在实验室用钙盐制取CaO2?8H2O(该反应为放热反应).
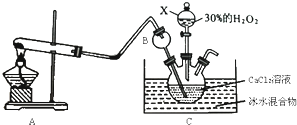
Ⅰ、第一部分:
(1)仪器B的名称为 ,作用是 .
(2)A为实验室制取氨气的装置,写出A中发生反应的化学方程式 .
(3)制取CaO2?8H2O一般在0℃~5℃的低温下进行,原因是 ;写出生成CaO2?8H2O的化学方程式 .
Ⅱ、第二部分:
欲测定产品中CaO2的含量,实验步骤是:已知:I2+2S2O32-=2I-+S4O62-
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol?L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
(4)判断此滴定实验达到终点的方法是: .
(5)CaO2的质量分数为 (用字母表示);
(6)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“无影响”、“偏低”或“偏高”).

Ⅰ、第一部分:
(1)仪器B的名称为
(2)A为实验室制取氨气的装置,写出A中发生反应的化学方程式
(3)制取CaO2?8H2O一般在0℃~5℃的低温下进行,原因是
Ⅱ、第二部分:
欲测定产品中CaO2的含量,实验步骤是:已知:I2+2S2O32-=2I-+S4O62-
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol?L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
(4)判断此滴定实验达到终点的方法是:
(5)CaO2的质量分数为
(6)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
考点:性质实验方案的设计,探究物质的组成或测量物质的含量
专题:实验设计题
分析:(1)根据B的特点构造结合实验原理来回答;
(2)实验室中用氯化铵和氢氧化钙固体制取氧气,据此书写方程式;
(3)高温下H2O2分解,会影响实验结果;根据装置中的物质以及性质结合产物来书写方程式;
(4)根据滴定结束前溶液为蓝色,滴定结束是溶液由蓝色变成无色分析;
(5)根据电子守恒及化学反应方程式找出过氧化钙与硫代硫酸钠反应的关系式,再根据题中数据计算出样品中过氧化钙的质量分数;
(6)根据空气中的氧气能够氧化碘离子,使碘单质的量增加,消耗的硫代硫酸钠增加分析.
(2)实验室中用氯化铵和氢氧化钙固体制取氧气,据此书写方程式;
(3)高温下H2O2分解,会影响实验结果;根据装置中的物质以及性质结合产物来书写方程式;
(4)根据滴定结束前溶液为蓝色,滴定结束是溶液由蓝色变成无色分析;
(5)根据电子守恒及化学反应方程式找出过氧化钙与硫代硫酸钠反应的关系式,再根据题中数据计算出样品中过氧化钙的质量分数;
(6)根据空气中的氧气能够氧化碘离子,使碘单质的量增加,消耗的硫代硫酸钠增加分析.
解答:
Ⅰ、(1)根据B的特点构造可以知道B是长颈漏斗,该装置可以防倒吸,故答案为:长颈漏斗;防倒吸;
(2)实验室中用氯化铵和氢氧化钙固体制取氧气,方程式为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O;
(3)高温下H2O2分解,会影响实验结果;根据装置中的物质以及性质结合产物来书写方程式;
长颈漏斗、防倒吸
(2)Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
(3)制取CaO2?8H2O一般在0℃~5℃的低温下进行,是为了防止高温下H2O2分解,根据装置C中的物质得出制取的原理方程式为:CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2?8H2O,故答案为:防止高温下H2O2分解;CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2?8H2O;
Ⅱ、(4)在滴定结束之前,溶液的淀粉与碘单质显示蓝色,当碘单质反应完全后,溶液变成无色,所以达到终点现象为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色,
故答案为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色;
(5)过氧化钙氧化碘化钾生成的碘单质,用硫代硫酸钠滴定时,消耗的硫代硫酸钠的物质的量为:cmol?L-1×V×10-3L=cV×10-3mol,根据氧化还原反应中电子守恒及题中反应方程式可得关系式:CaO2~I2~2S2O32-,过氧化钙的物质的量为:n(CaO2)=
n(S2O32-)=
×cV×10-3mol,
样品中CaO2的质量分数为:
×100%=
%,
故答案为:
%;
(6)在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高,
故答案为:偏高.
(2)实验室中用氯化铵和氢氧化钙固体制取氧气,方程式为:Ca(OH)2+2NH4Cl
| ||
,故答案为:Ca(OH)2+2NH4Cl
| ||
(3)高温下H2O2分解,会影响实验结果;根据装置中的物质以及性质结合产物来书写方程式;
长颈漏斗、防倒吸
(2)Ca(OH)2+2NH4Cl
| ||
(3)制取CaO2?8H2O一般在0℃~5℃的低温下进行,是为了防止高温下H2O2分解,根据装置C中的物质得出制取的原理方程式为:CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2?8H2O,故答案为:防止高温下H2O2分解;CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2?8H2O;
Ⅱ、(4)在滴定结束之前,溶液的淀粉与碘单质显示蓝色,当碘单质反应完全后,溶液变成无色,所以达到终点现象为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色,
故答案为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色;
(5)过氧化钙氧化碘化钾生成的碘单质,用硫代硫酸钠滴定时,消耗的硫代硫酸钠的物质的量为:cmol?L-1×V×10-3L=cV×10-3mol,根据氧化还原反应中电子守恒及题中反应方程式可得关系式:CaO2~I2~2S2O32-,过氧化钙的物质的量为:n(CaO2)=
| 1 |
| 2 |
| 1 |
| 2 |
样品中CaO2的质量分数为:
| ||
| ag |
| 3.6cV |
| a |
故答案为:
| 3.6cV |
| a |
(6)在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高,
故答案为:偏高.
点评:本题考查了性质实验方案的设计方法,题目难度中等,明确题干信息及实验目的为解答此类题的关键,解答过程中实验设计的步骤和实验方案的确定需要根据题干要求分析,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍.下列说法中不正确的是( )
| A、W、M的某种单质可作为水处理中的消毒剂 |
| B、电解YW2的熔融物可制得Y和W的单质 |
| C、相同条件下,W的氢化物水溶液酸性比Z弱 |
| D、X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |
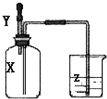 如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )
如图所示,集气瓶内充满某气体X,将滴管内的溶液Y挤入集气瓶后,烧杯中的溶液Z会进入集气瓶,然后又会有溶液被压回烧杯,则下列组合正确的是( )| ① | X是甲烷,Y是高锰酸钾溶液,Z水 |
| ② | X是HCl,Y是浓硫酸,Z溴水 |
| ③ | X是氨气,Y是盐酸,Z浓氢氧化钠溶液 |
| ④ | X是SO2,Y是氢氧化钠溶液,Z浓硫酸 |
| A、①② | B、②④ | C、③④ | D、②③ |
下列有关用途的说法中,错误的是:( )
| A、液态钠可用作核反应堆的传热介质 |
| B、在过渡元素中找寻半导体材料 |
| C、考古时利用l4C测定一些文物的年代 |
| D、SiO2是制造水泥、人造宝石、单晶硅的原料 |
在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)?C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L.下列叙述不正确的是( )
| A、在5 min 内该反应用C的浓度变化表示的反应速率为0.02 mol/(L?min) |
| B、5 min 时,容器内D的浓度为0.2 mol/L |
| C、该可逆反应随反应的进行,容器内压强逐渐增大 |
| D、5 min时容器内气体总的物质的量为3 mol |
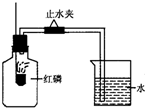 已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:
已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示: