题目内容
20.有七种物质:①甲烷、②苯、③聚乙烯、④聚1,3-丁二烯、⑤2-丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )| A. | ③④⑤ | B. | ④⑤ | C. | ④⑤⑦ | D. | ③④⑤⑦ |
分析 既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,则有机物含碳碳三键或双键,以此来解答.
解答 解:①甲烷与高锰酸钾、溴水均不反应,故不选;
②苯与高锰酸钾、溴水均不反应,故不选;
③聚乙烯与高锰酸钾、溴水均不反应,故不选;
④聚1,3-丁二烯中含碳碳双键,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,故选;
⑤2-丁炔含碳碳三键,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,故选;
⑥环己烷与高锰酸钾、溴水均不反应,故不选;
⑦环己烯中含碳碳双键,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,故选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关系,侧重分析与应用能力及烯烃、炔烃性质的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是( )
| A. | 原子半径 X>Y>Z | |
| B. | 非金属性 X>Y>Z | |
| C. | X、Y、Z的单质与氢气化合能力由弱到强 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
11.某元素的原子核外有三个电子层,其最外层电子数是内层电子总数的一半,则此元素是( )
| A. | Si | B. | P | C. | S | D. | Cl |
8.下列数值都是烃的相对分子质量,其对应的烃一定为烷烃的是( )
| A. | 54 | B. | 128 | C. | 42 | D. | 58 |
5.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3,其结构简式如图: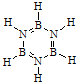 ,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:
,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:
(1)与(HB=NH)3互为等电子体的分子为C6H6(填分子式).
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中共有4个硼原子,4个氮原子.
(3)人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷.工业上采用LiAlH4和BF3,在乙醚介质中反应制得乙硼烷(B2H6),同时生成另外两种产物,该反应的化学方程式为3LiAlH4+4BF3$\frac{\underline{\;乙醚\;}}{\;}$2B2H6+3LiF+3AlF3.
(4)相关化学键的键能如表所示,简要分析和解释下列事实.
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化物,其原因为B-O键键能大于B-B键和B-H键,所以更易形成稳定性更强的B-O键.
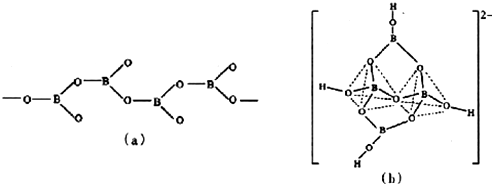
(5)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多碰酸根,其化学式为BO2-;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型sp2、sp3.
 ,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:
,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:(1)与(HB=NH)3互为等电子体的分子为C6H6(填分子式).
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中共有4个硼原子,4个氮原子.
(3)人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷.工业上采用LiAlH4和BF3,在乙醚介质中反应制得乙硼烷(B2H6),同时生成另外两种产物,该反应的化学方程式为3LiAlH4+4BF3$\frac{\underline{\;乙醚\;}}{\;}$2B2H6+3LiF+3AlF3.
(4)相关化学键的键能如表所示,简要分析和解释下列事实.
| 化学键 | B-H | B-O | B-B |
| 键能(KJ•mol-1) | 389 | 561 | 293 |
(5)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多碰酸根,其化学式为BO2-;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型sp2、sp3.

12.为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验.
请回答下列问题:
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是究温度对H2O2分解速率的影响;.
(3)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是C(填字母代号).
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图2、3所示的实验.请回答相关问题:
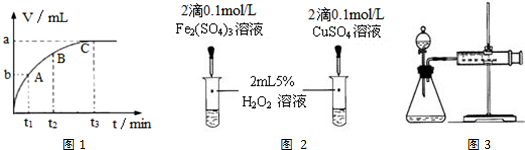
①定性分析:如图2可通过观溶液中气泡产生的速率,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是排除氯离子的干扰.
②定量分析:用图3所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是在同温同压下,收集40mL气体所需的时间.
(6)通过对上述实验过程的分析,在实验设计时,要考虑控制变量(或对比)方法的应用.
请回答下列问题:
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴 1mol/LFeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增多. |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2 溶液 | 两支试管中均未明显见到有 气泡产生. |
(2)实验①的目的是究温度对H2O2分解速率的影响;.
(3)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是C(填字母代号).
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图2、3所示的实验.请回答相关问题:

①定性分析:如图2可通过观溶液中气泡产生的速率,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是排除氯离子的干扰.
②定量分析:用图3所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是在同温同压下,收集40mL气体所需的时间.
(6)通过对上述实验过程的分析,在实验设计时,要考虑控制变量(或对比)方法的应用.
9.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A. | 单质的熔点:X>Y | |
| B. | 最高价氧化物对应的水化物的酸性:W>Y | |
| C. | 4种元素的单质中,W单质的熔、沸点最高 | |
| D. | 干燥的W单质具有漂白性 |
10.由环己醇制取己二酸己二酯,最简单的流程途径顺序正确的是( )
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应 ⑦中和反应 ⑧缩聚反应.
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应 ⑦中和反应 ⑧缩聚反应.
| A. | ①②⑤⑥ | B. | ⑤③④⑥ | C. | ⑤②③⑧ | D. | ②③④⑦ |
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. ,C的分子式C2H5Cl,D的结构简式CH3CH2OH.
,C的分子式C2H5Cl,D的结构简式CH3CH2OH. .
.